TOPICS
特集記事培養関連
培養技術者必見!学生さんにもお勧めしたい細胞培養ガイド
弊社はこのような状況を鑑み、少し視点を変えた細胞培養ガイドを作成いたしました。各操作の作業手順(プロトコル)は、基本的な操作に注釈を入れて記述し、これから重要な課題になると予想される「細胞の性質を変化させない培養、搬送、保存、管理」についても言及し、読み物としても楽しんでいただけるようにいたしました。本「細胞培養ガイド」が、皆様の培養に対する興味を増大させ、更には研究の手助けとなることを切に願っております。
また、今後も医学の進歩・技術革新に伴い、内容も更新していく予定です。
本ガイドへのご意見・ご質問等も随時承っておりますので、ぜひお問い合わせください。
*本資料はPDF版細胞培養ガイドのブラウザ版です。下部のボタンからPDF版をダウンロードしていただくことも可能です。
*PDF版に古い内容の記載があるため、PDF版と一部内容が異なる部分がございます。
1. はじめに(細胞培養の目的)
2. 細胞及び培養方法の選択
2.1 細胞の入手方法
2.2 基本的な培養方法
2.2.1 静置培養(単層培養)
2.2.2 浮遊培養
2.2.3 回転培養(ローラー培養)
2.2.4 旋回培養(振とう培養)
2.2.5 担体を使用した培養
2.2.6 三次元培養
3. 培養設備、機器/器具
3.1 実験室(実験区域)
3.2 実験機器
3.2.1 無菌環境区域
3.2.2 培養関連機器
3.2.3 細胞保存容器(機器)/器具
3.2.4 細胞観察機器
3.2.5 器具滅菌機器
3.2.6 その他培養器具
3.3 機器選択ガイド
【コラム 1】CO₂インキュベーターの選択
4. 培養の準備
4.1 培養機器の準備(使用前の点検)
4.2 培養容器の準備
4.3 培地、試薬の準備
4.4 血清の準備
4.5 作業時の注意
5. 基本的な細胞培養技術
5.1 細胞の増殖(増殖曲線 )
5.2 細胞融解(解凍)
5.3 細胞数のカウント
5.3.1 細胞計数盤でのカウント
5.3.2 生細胞率の算出
5.4 細胞の継代(接着細胞)
5.5 細胞の継代(浮遊細胞)
5.5.1 培地の交換
5.6 細胞の保存・凍結(接着細胞)
【コラム 2】意外な狙い目?細胞融解の最終兵器!
6. 細胞の搬送
6.1 細胞の搬送
6.2 再生医療に用いる細胞の搬送
7. 細胞の評価
7.1 コンタミネーション
7.2 マイコプラズマ汚染の対策
【コラム 3】その細胞は目的の細胞?(STR、BAC Array、Proteome)
8. 細胞培養(技術)と知的財産
8.1 MTA(Material Transfer Agreement)
8.2 特許出願戦略
8.3 特許出願と学会発表
9. おわりに
1. はじめに(細胞培養の目的)
生命現象のメカニズムの解明及び、薬剤や外的刺激が細胞に及ぼす効果の評価などに利用することができ、様々な実験系、評価系が確立しています。
また、医薬品となる有用なタンパク質を生産させるために遺伝子操作を行った細胞を大量培養するなど、工業的利用としての細胞培養技術はすでに大きな産業として成り立っています。
ただし、細胞培養は他の化学や物理学の実験とは異なり「生きた素材」を扱うという点を十分に認識して取り掛かる必要があります。細胞を用いる実験においては、目的とする機能や効果などが明確に判断できるような培養条件を策定、管理を実施して、バラツキを可能な限り最小限に抑えることによって、条件と結果との因果関係がより正確に把握することができます。
事前に使用する細胞や培養方法などの項目をしっかり調べてから培養実験に取り掛かるようにしてください。
なお、細胞培養技術も常に新しい手法が生み出されています。新たな培養方法を採用した場合、以前の培養結果と直接比較ができないデメリットもありますが、より効率の良い実験が可能となることもあります。常に新しい情報を取得して、最適な実験系を選択できるように心がけてください。

2. 細胞及び培養方法の選択
2.1 細胞の入手方法
実験に使用する細胞を持っていない場合は、細胞供給機関から入手する手続きが必要となります。主な入手機関は以下の通りです。
- JCRB細胞バンク
医薬基盤・健康・栄養研究所 - 医用細胞資源センター
東北大学加齢医学研究所 - RIKEN BRC - 細胞材料開発室
理化学研究所バイオリソースセンター - ATCC(American Type Culture Collection)
取扱い:住商ファーマインターナショナル - ECACC(European Collection of Cell Cultures)
取扱い:ケー・エー・シー
上記機関に取扱いがない場合は、希望する細胞を樹立した研究者から直接分けてもらうようにお願いする必要があります。
供与してもらった細胞の品質検査及び、管理は自らの責任で実施する必要がありますので、しっかりと調査した上で供与をお願いするようにしてください。
2.2 基本的な培養方法
細胞培養を行うにあたり、どのような器具や装置を用いるか選択しなければいけません。
ディッシュの平面上に培養するものもあれば、スピンナーフラスコや培養バッグを用いた浮遊系の培養、更にはゲルやディスクベッド等の3次元構造支持体を用いた培養など、細胞の性状や実験目的によって様々な方法を選択することができます。
実験計画を策定するにあたり、細胞の選択とともに培養方法の選択も合わせて進めるようにしてください。
以下に、基本的な培養方法を列挙します。
2.2.1 静置培養(単層培養)
細胞を培養容器に接着させ、単層の状態で培養する方法です。基本的には正常細胞を培養系に移すと単層状に伸展・増殖します。
単層上に伸展するので Monolayer Culture(単層培養)と呼ばれ、培養容器の培養面積を覆い尽くすと、正常細胞ではそれ以上の増殖が抑制されますが(接触阻止現象:contact inhibition)、株細胞では過増殖状態となり、形態の変化や死滅の原因となります。
容器はペトリディッシュ(シャーレ)、培養フラスコ、マルチウェルプレートなどが用いられ、大量培養の必要がある場合は、容器の数を増やして対応します。また、幹細胞の培養ではフィーダー細胞を用いた培養方法も確立されており、目的の細胞の機能を促進させる補助的な役割を果たす他の細胞種をあらかじめ培養し、増殖しないように不活化してから目的の細胞を播種することで、幹細胞の増殖や分化、多様性の維持などの有効な手法となっています。昨今、化学固定フィーダー細胞の開発や、培地の改良によるフィーダーレス培養など、著しく技術は進化しています。
 |
 |
| ペトリディッシュ | 培養フラスコ |
2.2.2 浮遊培養
細胞を培地に浮遊させた状態で増殖させる培養方法です。血球由来の細胞は、培養容器に接着せずに浮遊した状態で増殖しますので細胞が接着しないようにコーティングされた浮遊系細胞用の培養容器を用います。大量に培養する場合は、振とうフラスコやスピンナーフラスコを用いて培養します。血球由来の細胞以外にも、癌化した細胞や意図的に浮遊状態での培養を可能にした細胞などがあります。
浮遊系細胞の培養は培養容器の接着可能面積に依存しないため、大きな培養容量(体積)が確保できます。そのため、大量培養に有利な細胞として利用され、省スペースでの生産レベルの大量培養に貢献しています。
しかし、接着系から浮遊系にアダプトされた細胞の注意としては、すでに浮遊培養が可能になって長期の実績を持つ細胞以外の(直近で選別された)細胞では、オリジナルの細胞株の性状や特徴を喪失していたり、異なる機能を獲得していたりする可能性(危険性)があることも理解した上で培養を実施する必要があることです。

スピンナーフラスコ
2.2.3 回転培養(ローラー培養)
ローラーボトルと呼ばれる回転培養専用の培養容器を緩やかに回転させながら、そのボトルの内壁に細胞を接着させて培養する方法です。培養方法の基本としては、単層培養と同じであり培養条件の検討が比較的容易に行えます。相対的に少量の培地で、効率的なガス交換が可能であり、ボトル本数を増やすことで大量培養に対応することができます。一番シンプルな大量培養方法と言うことができるでしょう。
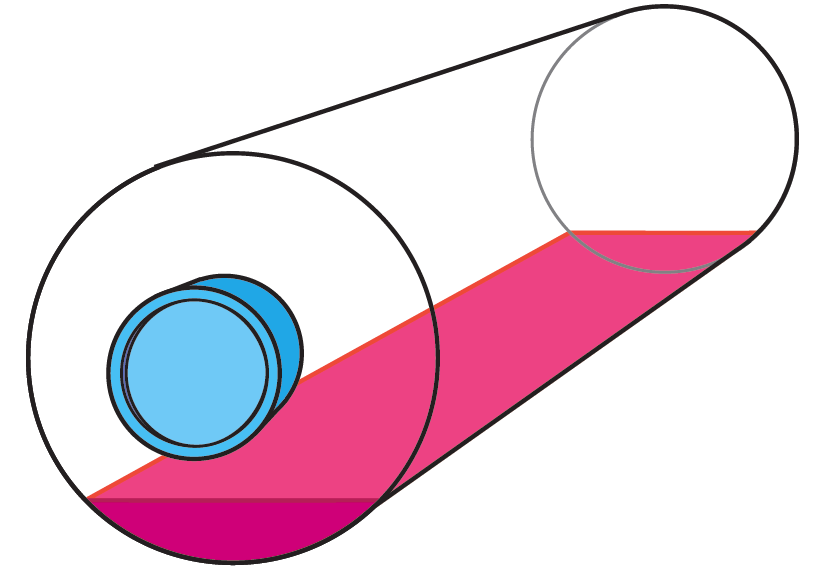
ローラーボトル
2.2.4 旋回培養(振とう培養)
浮遊系細胞の培養方法として利用され、主に菌体や植物細胞の培養等に利用されていました。また、リンパ球由来細胞の培養や、スフェロイド形成(細胞集塊)に用いられることも多く、後者については、適切な回転速度で水平に旋回させると浮遊物が中央に集まる性質を利用しています。近年、元々接着系の細胞を浮遊系にアダプトして、高いタンパク質の発現能力を有する細胞が開発されており、動物細胞の培養にも広く利用される培養方法となっています。浮遊系細胞は回収作業が容易なため、生産用の大型容器で培養する細胞を必要な量にまで増やすための作業に、スピンナーフラスコと共によく用いられています。(バイオ医薬品生産に用いる種細胞の培養など)

振とうフラスコ
2.2.5 担体を使用した培養
マイクロキャリアー、ディスクベッドなど小さなキャリアー(ビーズなどの担体)の表面に細胞を生着させて、そのキャリアーを攪拌することで、あたかも浮遊培養のような手法で行う接着性細胞の培養方法です。大きな培養面積と培養容量が確保できるので、大量培養が可能となっています。また、近年は、キャリアーやディスクベッドを専用容器にセットし、そこに培地を循環させて高密度培養が可能なバイオリアクターとして利用することが可能となっています。特にディスクベッドタイプの担体は、適切に浮遊させるための比重調整などを考慮しなくても良く、繊維質マトリックスなど、種々の多孔質担体が開発されています。

マイクロキャリアースピンナーフラスコ
2.2.6 三次元培養(多孔性ゲル、微重力 etc)
単層培養などの2次元(平面)での培養とは異なり、高さ方向(厚み)でも細胞を増殖させる立体的な培養方法です。細胞の接着及び増殖を支え、立体的3次元構造を維持するための担体をスキャフォールド(足場)と呼び、その足場が作り出す培養環境はより生体内の状態に近く得られた結果も生体内の反応との相関性が高いと考えられています。再生医学研究を進める上で生体内に近い環境での培養は非常に重要であり、様々な材質、構造の足場の開発が進められています。例えば多孔性軟質ゲルや、生体親和性の高い微小孔材料を用いて細胞塊を作る試みがなされており、より生体内の性状に近い細胞が得られています。また、微小重力などの、培養の「場」の環境を制御することで均一性の高い品質の細胞塊を作る試みもなされており、培養に必須と言われていたタンパク質を用いずにES細胞の分化を抑制したとの報告もあります。
その他にもスフェロイド形成に有利な微細構造を有する無機物を用いた足場の開発も進められており、三次元培養法は再生医学研究を進める上で、もっとも注目されている培養方法の一つとなっています。
3. 培養設備、機器/器具
3.1 実験室(実験区域)
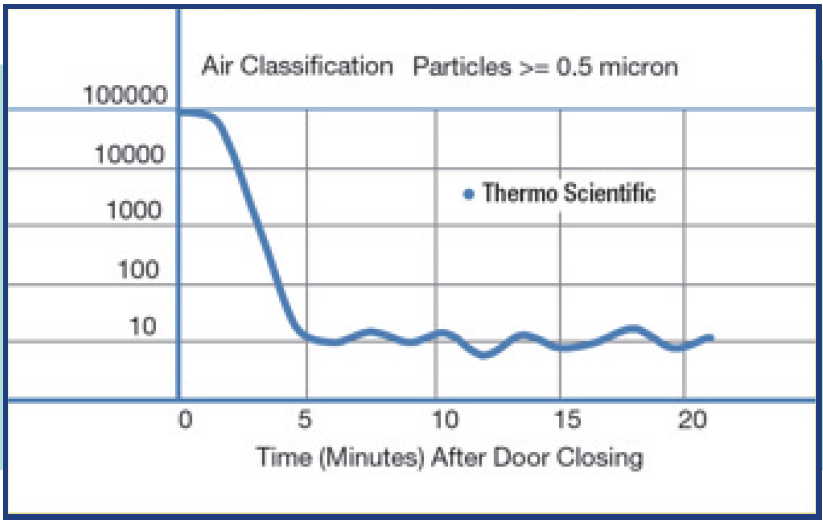
細胞を汚染から防ぐためには、クリーンな環境が必要です。室内に浮遊している微生物の管理が重要であり、通常の実験室と区切られた空間を確保してください。また、コンタミネーション(試料汚染)の抑制策として、空調からの風が直接培養機器に当たらないような位置に設置する工夫も必要となります。なるべく作業者の移動が少なくて済むような作業の動線を考慮した実験室のレイアウトが望ましいです。汚染の原因の多くは作業者の無駄な動きに起因していると考えられるからです。

培養室レイアウト例
3.2 実験機器
3.2.1 無菌環境区域
クリーンベンチ(セフティキャビネット)、アイソレーターなどの無菌エリアが必要となります。試料自体の無菌性の維持を重視したクリーンベンチと、作業員の安全性と試料の外部漏洩防止を最重視したセフティキャビネットとは、目的に応じて選択する必要があります。
| クリーンベンチ(循環式) | セフティキャビネット |
 |
 |
| 試料を清浄区域で扱うことを最優先 | 作業者の安全性の確保が際有性 |
3.2.2 培養関連機器
CO₂インキュベーター、低速遠心機、蒸留装置、試薬保冷庫など、培養のために必要な機器があります。培養装置は培養方法により回転培養装置、スターラー、シェーカーホロファイバー、バッグ培養など、様々な機器が利用されています。
細胞の種類、必要容量、タンパク質発現など研究の目的に合った細胞の機能を最大限に活かすことができる培養機器を選択してください。
3.2.3 細胞保存容器(機器)/器具
細胞を凍結・保存する容器(機器)の選定は、その細胞の保存期間により、どの保存温度帯を選択するかで容器(機器)が決まります。一時的な保存の場合は、−80℃の超低温槽での保存も可能ですが、長期間の保存、特にマスターセルバンクとして細胞の品質維持が重要となる場合は、液体窒素容器での保存が必須です。また、保存容器の温度だけでなく、クライオチューブの出し入れ時の温度上昇を抑える工夫がなされた器具や、液体窒素がチューブ内へ入らないように考えられた外装フィルムや溶着容器もあり、細胞の重要度に合わせた保存方法、器具が選択できるようになっています。
 (リンク) |
 (リンク) |
| 大型液体窒素保存容器 | 小型液体窒素保存容器 |
3.2.4 細胞観察機器
人の眼で見ることができる大きさは、おおよそ0.1mm(100μm)と言われており、髪の毛の太さ程度です。種類によって多少異なりますが、細胞の大きさは、約20~100μm程度です。この小さな細胞の観察には顕微鏡が必要です。
顕微鏡にも複数の方式があって、生物顕微鏡(透過型顕微鏡)、倒立顕微鏡(標本を下方から観察)、位相差顕微鏡(透明なサンプル
像に明暗コントラストを強調して観察)、蛍光顕微鏡(サンプルに蛍光を発光させて高い感度で部位識別が可能)などがあり、実験用途に応じて使い分けます。モニター付きのタイプもあり、目が疲れず複数人数で観察できる顕微鏡としてとても便利です。
また、培養細胞をCO₂インキュベーターから取り出さないで継時的に自動で観察(撮影)できる装置も登場しており、リアルタイム観察、記録、解析が可能となっています。

倒立型顕微鏡
3.2.5 器具滅菌機器
オートクレーブ、乾熱滅菌器、濾過滅菌などより、滅菌対象に適した方法を選択します。
基本的にはオートクレーブを用いて器具類の滅菌を行いますが、濡れない方が都合の良いガラス器具や、オートクレーブに入らない大きさの金属製のトレーなどは、乾熱滅菌器を利用します。液体の滅菌には濾過滅菌やオートクレーブが使われます。対象物に適した滅菌方法を選択して作業してください。
3.2.6 その他培養器具
ピペット関連:
マイクロピペット/オートピペット/ディスポピペット/チップなど
培養容器:
培養ディッシュ/マルチウェルプレート/培養フラスコ/細胞計数盤など
遠心・保存容器:
遠沈菅(15mL、50mL)/マイクロチューブ(1.5cc)/クライオチューブなど
滅菌関連:
濾過滅菌フィルター( 0.22、0.45μm)エアーフィルター/オートクレーブバッグ
など
3.3 機器選択ガイド 詳細は弊社ウェブサイトをご覧ください https://www.wakenbtech.co.jp
ESCO社 バイオクリーンベンチ
1ランク上のULPAフィルターを採用し、より安全性を高めたバイオクリーンベンチ
Airstream・PRO(BCB G4モデル) BCB-2E7 G4/BCB-3E7 G4/BCB-4E7 G4/BCB-5E7 G4/BCB-6E7 G4
ESCO社 バイオハザードセフティキャビネット ClassⅡ Type A2
ULPAフィルターで極めて高い清浄度を実現し、DC ECMモーター搭載で安定した風量を確保した
ニューモデル
Airstream(AC2 G4モデル) AC2-2N7 G4 8"/ AC2-3N7 G4 10"/ AC2-4N7 G4 10"/AC2-5N7 G4 10"/AC2-6N7 G4 10"
 (リンク) |
 (リンク) |
| BCB-4E7 G4 | AC2-4N7 G4 10" |
CO₂インキュベーター
小型から大型まで取り揃え、滅菌機能、HEPAフィルター搭載、低温対応など豊富なバリエーションを提供
(小 型)
ワケンビーテック社
・コンパクトCO₂インキュベーター MINIcell
・コンパクトCO₂インキュベーター MINIcell-35SE
ESCO社
・CelCulture CO₂インキュベーター CCL-050
 (リンク) |
 (リンク) |
| コンパクトCO₂インキュベーター MINIcell |
コンパクトCO₂インキュベーター MINIcell-35SE |
(中 型)
サーモフィッシャーサイエンティフィック社
ダイレクトヒートタイプ
・フォーマ ダイレクトヒート 310GP/320GP (HEPAフィルター搭載)
・Vios iDx 165 (HEPAフィルター・乾熱滅菌搭載)
・フォーマ ステリサイクル i160 (HEPAフィルター・乾熱滅菌搭載)
・HERAcell CO₂インキュベーター 150i (湿熱除染)
・BB150 CO₂インキュベーター BB150
ウォータージャケットタイプ
・フォーマ シリーズ3 4110/4120/4130/4140(HEPAフィルター搭載)
ワケンビーテック社
・自動化対応CO₂インキュベーター NexCell R
ESCO社
・CelCulture CO₂インキュベーター CCL-170
(大 型)
サーモフィッシャーサイエンティフィック社
ダイレクトヒートタイプ
・Vios iDx 255 (HEPAフィルター・乾熱滅菌搭載)
・フォーマ ステリサイクル i250 (HEPAフィルター・乾熱滅菌搭載)
・HERAcell CO₂インキュベーター 240i (湿熱除染)
・フォーマステリカルト 3307/3310(HEPAフィルター・乾熱滅菌搭載)
・フォーマリーチイン 3950
N-BIOTEK社
・aniCell 加湿対応シェーカー搭載 CO₂インキュベーター NB-206CXL/NB-206CXXL
ワケンビーテック社
・NeXCell P870 生産用大型CO₂インキュベーター
・MaxCell Giant 大型インキュベーター
超音波ホモジナイザー
ハンディタイプから大容量処理タイプまでを取り揃え、組織から細胞を単離するときや、培養細胞から
核酸/タンパク質の抽出、またはDNA断片作成などに使用され、細胞破砕・均一化、免疫沈降、次世代
シーケンサーの前処理などに利用されている汎用性の高い超音波方式のホモジナイザーです。
QSONICA社
Q55 微量超音波ホモジナイザー(出力55W) 小型ハンディ(フィンガースイッチ)
Q125 微量超音波ホモジナイザー(出力125W) 小型ハンディ
Q500 超音波ホモジナイザー(出力500W) 高出力
Q700 超音波ホモジナイザー(出力700W) 高出力・高機能(プログラマブル)
Q800R DNAシェアリングシステム(出力750W) DNAせん断用超音波ホモジナイザー
 (リンク) |
 (リンク) |
 (リンク) |
| Q55 | Q700 | Q800R |
【コラム 1】 CO₂インキュベーターの選択
細胞培養に必要な装置を揃えるとき、まず最初に思い浮かぶ装置と言えば、CO₂インキュベーターではないでしょうか?まさに培養装置の代名詞とでもいうべきものですが、意外とその全貌(?)をご存知の方は少ないのかもしれません。様々なメーカーがCO₂インキュベーターを販売していますし、どれを見ても外観上での大きな違いはなく、基本はコントローラーが付いている四角い箱でしかありません。
しかし、その機能は機種ごとによって大きく異なります。
まずその大きな違いは加温方式で、ウォータージャケット方式と、ダイレクトヒート方式に分かれます。お湯に囲まれているかヒーターに囲まれているかの違いと考えてください。
次に、庫内の無菌性維持のために様々な方策がなされており、例えば、ダイレクトヒート方式では、総じて滅菌機能(乾熱式/湿熱式)が装備されている機種が多く、培養毎に無菌性を確保できるようになっています。
更に、庫内にHEPAフィルターが装備されている機種もあり、庫内の循環気流を高い清浄度に保つことができます。更に、受精卵(発生工学)や癌研究などでは低酸素培養環境の維持が必要とされており、大小様々なチャンバーの低酸素制御可能な機種が登場しています。
その他、まだまだCO₂インキュベーターの進化は止まりません。滅菌、HEPAフィルターだけにとどまらず、庫内のUV殺菌、過酸化水素滅菌、純銅チャンバー仕様などコンタミ防御対策が施された機種が目白押しです。
ただ、このように様々な機能を有する機種が登場しているのですが、残念ながらすべての機能を併せ持つ機種は登場していません。
こうして多くの機種が揃っていると選ぶ方も大変かもしれませんが、重要なのは培養に必要な基本性能を確実に把握しておくことです。
細胞培養装置ですから、いくら付加機能が多くても、細胞に最適な状態を維持できなければ意味がありません。やはり、培養時の細胞の環境を一番に考えるべきなのでしょう。
さて、細胞にとって良い環境とはどのような環境でしょうか?もちろんインキュベーター庫内の温度、湿度、ガス濃度は重要ですが、当の細胞にとっては自分が生活(増殖)する「培養液の中の環境」こそが重要であり、この培養液の環境を細胞に最適な状態にするのがCO₂インキュベーターの役目です。基本的に必要なのは、快適な温度と湿度環境です。各メーカー、庫内循環エアーが必ず加湿用水に接触して、湿気を含んだ温かいエアーが庫内を循環するようにデザインされた製品を登場させ、温度と湿度を考慮しています。
特にThermo社の製品は、充分に湿気を含ませたエアーをHEPAフィルターに通過させ、極めて清浄な状態にして循環させています。
このようなシステムで培地の温度低下、蒸発を最小限に抑え、細胞に適したクリーンな環境が維持されているのです。
ただ、これらの特色もカタログに記載された仕様(数値)だけではなかなか読み取れないことが多く、どうしても滅菌方法などの目立つ付加機能に目が向いてしまう傾向にあります。
そこで、細胞培養機器の選択時は、自分が培養細胞になったつもりで部屋(庫内)の環境を考えてみるのはいかがでしょうか。快適な温度と湿度に保たれて、適度な成分に調節されたきれいな空気に満ちた部屋で過ごしたい…
案外この考え方が、細胞培養の上手・下手を分けるポイントになるのかもしれません。
4. 培養の準備
4.1 培養機器の準備(使用前の点検)
細胞培養に必要なCO₂インキュベーター、クリーンベンチ(安全キャビネット)などの機器は、確実に稼働しているかあるいは、清潔な状態に保持されているか?など、事前にしっかり点検をしておいてください。
近年、各種滅菌機能が装備されているCO₂インキュベーターが販売されており、培養前に庫内をクリーンな状態にすることが可能です。また、アルミブロックや恒温バスなど指定の温度に到達しているよう事前に稼働させておくと効率の良い実験が行えます。
4.2 培養容器の準備
細胞の特性によって、目的に適した培養容器を選択してください。培養フラスコ、ペトリディッシュ(シャーレ)、スピンナーフラスコ、培養バッグなど、様々なメーカーから様々な容量の容器が販売されています。
主な培養液量の目安は以下の通りです。
- ペトリディッシュ:接着細胞
35mm 培養液容量 1~2mL
60mm 培養液容量 3~6mL
100mm 培養液容量 8~12mL - 培養フラスコ(Tフラスコ):接着細胞
T-25 培養液容量 3~7.5mL
T-75 培養液容量 10~15mL
T-150 培養液容量 15~30mL - 培養フラスコ(Tフラスコ):浮遊細胞 ※
T-25 培養液容量 10mL 以下
T-75 培養液容量 50mL 以下
T-150 培養液容量 150mL 以下
※ 通常は接着細胞と同程度の液量で培養します
4.3 培地、試薬の準備
培養する細胞に適した培地を選択します。培地には様々な種類があり、メーカーによって組成、添加剤などが異なっている場合もありますので、それぞれ取扱説明書をよく読んで調製及び、貯蔵してください。
その他、頻繁に使用する試薬の準備も無菌条件下で行ってください。
- PBS(リン酸緩衝生理食塩水)
細胞の洗浄などに用います。通常、細胞培養用にはCa、Mgイオンが除かれているものを使用し、PBS(-)と記載されます。 - トリプシン溶液(細胞分散用酵素溶液)
接着細胞の分散にはトリプシンまたは、トリプシン/EDTAによる処理が広く用いられています。メーカーや、種類により使用方法が異なることがありますので、それぞれの使用条件を確認した上で使用してください。 - 細胞染色液(生死判別用)
細胞計数盤を用いて細胞数を数える時に細胞の生存率を割り出すために、生細胞と死細胞を染め分けるのに使用します。
0.5%トリパンブルー溶液
0.02%エリスロシンB溶液 他 - 細胞凍結液、細胞凍結培地
自前での調製する場合と、市販品を用いる場合があります。基本的には合成培地に牛胎児血清などの増殖因子を添加し、5~10%のDMSOを加えたものを使用します。また、安定した凍結保護作用を持つ優れた凍結保存液も市販されており、それらを利用する場合は各々の取扱説明書に従い調製して下さい。
細胞凍結保存溶液
4.4 血清の準備
多くの細胞培養では、血清を添加した培地を用います。主としてウシの血清が使われ、以下の3通りの選択があります。
- 胎児血清(FCSまたはFBS)
- 新生児血清(NBS)
- 子牛血清(CS)
どの血清を用いるかは、増殖支持と細胞障害などの要因を比較、検討して選択します。
おおよその選択基準は以下の通りです。
- 増殖支持能力 (1>2>3)
- 細胞傷害性因子(3>2>1)
また 同じメーカーの血清でもロット差があるので、目的の細胞に適しているかどうかを予めチェックする必要があります(各メーカーでロットチェック試験用の血清を用意しています)。一般的には血清の補体成分作用による細胞障害を阻止する目的で、非働化処理(56℃・30分加熱)を行います。
1. 冷凍保存されていた血清を溶かす

2. 恒温バスの温度を56℃に設定し、水温が設定温度に到達するのを確認する

3. 恒温バスに血清ボトルを入れ、血清が完全に溶けていることを確認する

4. 血清ボトルがしっかり浸かった状態で、30分放置する

5. 使用する容量を考慮して小分けする
※ 非働化は必須ではなく、細胞によっては必要ないとの考えもありますので、事前に検討してください。
4.5 作業時の注意
作業の前にヒビテン(0.1~0.5%水溶液)などでよく手を洗います。クリーンベンチ内は、70%エタノールを用いてよく清拭してください。培養に使用する材料や器材も同様に、70%エタノールでよく拭いてからクリーンベンチ内に入れてください。
作業中は、無駄な会話や咳、くしゃみなどは厳禁です。また、クリーンベンチ外のものへの接触は可能な限り避けてください。触れた場合は70%エタノールを吹きかけてよく消毒してください。基本的に、一度に扱う細胞は一種類とし、クロスコンタミネーションやエアロゾルによる汚染の拡散を予防してください。
※ ヒビテン消毒液は皮膚に対する刺激が少なく、残留して持続的な抗菌作用を発揮するため、手洗いなどに有効です。
用途によってアルコールと使い分けると良いでしょう。
5.基本的な細胞培養技術
理由は、高い増殖性を持ち、その性状がよく知られていること、そして、細胞バンクから容易に入手でき、実績が多くあるので他所での実験データを参考にすることができるからです。
そして、これまで多くの研究者が細胞培養を元にし先進の研究を進め、科学の発展に大きく寄与していることは疑いようがありません。細胞培養は有用な実験材料を安定して確保できる重要な技術なのです。ただし、注意も必要です。いずれの細胞も長期間の培養、多くの継代
(Passage)数を重ねると、元の細胞の性質を必ずしも維持しているとは限りません。ですので、継代数管理やコンタミネーション及び、細胞の変化の確認が重要となるのです。※2
※1 有限増殖性の株化細胞も存在します ※2 P24からの「7. 細胞の評価」を参考にしてください
5.1 細胞の増殖(増殖曲線)
細胞培養の増殖には3つの増殖フェーズと、1つの死滅フェーズがあります。
- 誘導期(lagフェーズ)
凍結融解後や植え継ぎ後など、新しい培養環境に適応するまでの期間。
この期間の細胞はほとんど増殖しません。 - 対数増殖期(logフェーズ)
細胞固有の倍加時間(Doubling time)で増殖する期間。
非常に活発に増殖します。 - 定常期(Plateauフェーズ)
一定の数以上に増殖しなくなる期間。
細胞密度の上昇、栄養分の枯渇、老廃物の蓄積などが影響しています。 - 死滅期(Death フェーズ)
細胞によって緩やかに死んでいくものや急激に死滅するものなどがあります。
株化細胞を培養するにあたり、適正な継代培養の条件(希釈率や継代間隔等)を知るためにはその細胞の増殖曲線を作成することが重要となります。この増殖曲線により最適な継代のタイミング(通常、対数増殖期に実施)を的確に推測することができます。細胞の分裂回数対数増殖期の細胞は、等比数列的(2n)に分裂して増殖していきます。
このnは、当該細胞の分裂回数(populationdoublings, PDs)を示しています。

増殖曲線例
5.2 細胞融解(解凍)
凍結保存チューブ内の凍結細胞を融解させる作業の基本は「素早く融解」です。細胞内での再結晶(微細な氷結が大きな氷結に成長する)を抑制し、更に凍結保存液などの細胞毒性が働かないように工夫されている処理方法です。迅速な作業のために、全ての準備ができてから凍結細胞を取り出すようにして、融解後の培養に最適な播種密度を設定して、培地の量を調製してください。
液体窒素(液相)で保存されたチューブは、取り出し後の急激な温度上昇によって液体窒素が一気に気化(蒸発)し、チューブを破損させることがあります。
(注)必ず手袋、フェイスガードを着用して作業をしてください。
1. 恒温バス(水浴槽)を37℃に温めておく。

2. 15mLチューブに、培養用に調整した培地を10mL入れ、37℃に温めておく。

3. 液体窒素容器から凍結細胞保存チューブを取り出す。

4. チューブを取り出してすぐに蓋を少し緩め、気化した窒素ガスを放出する。(蓋を90度ほど回して緩めて、チューブ内のガスを放出してから再度緩める)※1

5. 37℃の恒温バスにチューブを浸す。蓋が水に浸からないよう注意し、蓋の5mmくらい下まで浸します。※2

6. 凍結保存溶液が60~70%融解するまで水浴で保持(氷片が浮いている状態)して、引き上げて軽く振って氷片が融けるのを確認してから迅速に氷冷する。(クールダウン)※3

7. 引き上げたチューブの表面をきれいに消毒し(特に蓋部分)、氷冷しながらクリーンベンチ内へ入れる。ベンチ内に氷を入れたくない場合は冷却型アルミブロックなどを利用する。(4℃)

8. 予め37℃に温めておいた培地(10mL)の入った15mLチューブ内に、融解した細胞液を加えて攪拌する。

9. 遠心(130~150G/5分)後、アスピレーターで上清を取り除く。

10. 15mLチューブ内の細胞ペレットに培地を加え培養容器に播種して培養を開始する。

11. 一晩、CO2インキュベーター内で培養する。
※1 -80℃フリーザー及び、液体窒素(気相)保存のチューブでは、窒素ガス放出作業は不要です。
※2 インキュベーターに入れるなど、ゆっくりと融解すると、ほとんどの細胞で生存率が低下します。恒温バスや融解専用機の使用をお勧めします。
※3 サンプルを一気に温めて0~5℃程度にした後、培地を加えるまでの間、一旦氷冷することでDMSOなどの保護剤の細胞毒性を抑えること
ができます。素早く融解するだけでなく、新たな培地を加えるまでの時間を如何に短くするかが、細胞を良い状態に保つ重要なポイントとなります。
5.3 細胞のカウント
培養細胞数のカウントは、増殖能の確認や継代のタイミングを計るなど、細胞を用いた実験では必須となります。更に、遺伝子の導入効率や凍結融解時の状態確認などでも、操作前と操作後の細胞数をカウントし、比較することはとても重要な操作となっています。
5.3.1 細胞計数盤でのカウント
プロトコル:ワケンカウンターを使用しての計数
1.細胞懸濁液をピペットなどでよく撹拌して、すぐに細胞計数盤のサンプル注入口に流し込む。※1

2.1枚の計数盤で2サンプルを測定する場合は、上記の 1. の作業をもう片方のサンプル注入口にて繰り返します。※2

3.細胞計数盤を顕微鏡ステージに置いて、4つの計数室の細胞数を順次カウンターにて数えて加算します。

4.加算された細胞数をNとして、下記の数式にて細胞密度を計算します。
細胞密度=(N/4)×10⁴個/mL ※3
※1 サンプル注入後、細胞が沈下するのを1~2分待ってから計数すると、より確実に計数できます。
※2 懸濁液量は多すぎても少なすぎても、誤差が大きくなります。
※3 あらかじめ細胞懸濁液を希釈した場合は、希釈倍数を更に乗じてください。
注意事項
より正確な計算値を得るため、4つの係数室全てを計数し、加算してください。
細胞の生死判定のために染色液を利用する場合は、混和後20分以内に計数するようにしてください。
染色液に敏感な細胞は5分以内に計数してください。
サンプル注入後は速やかに計数してください。長時間放置しておくと正確な計数ができなくなります。
計数室の4辺の格子線上の細胞を計数する場合、左と上の2本の線上の細胞は数え、右と下の2本の線上の細胞は数えないでください。
(下図参照)

ワケンカウンター(WC2-100/WC2-100S)
シンプルなグリッドパターンで、観察が容易な培養細胞用のディスポーザブル細胞計数盤です。
1枚で2サンプルの計数が可能です。
5.3.2 生細胞率の算出
細胞を用いた実験において、生細胞の割合をきちんと把握することはとても重要です。
細胞の生存率を把握するためには、生細胞と死細胞を区別する必要となります。
一般に、生細胞よりも死細胞のほうが膜の透過性が高いことを利用し、トリパンブルーなどの色素を指示薬として用い、細胞生存率を算出しています。
その他、MTT試薬を利用してホルマザンの生成量による生細胞数の算出や、生細胞と死細胞を特異的に染める蛍光試薬を用いたものなど、様々な方法などがあります。
トリパンブルー計数法
死細胞は細胞膜がもろくなり、生細胞よりも膜の透過性が高くなります。トリパンブルーは濃い青色の色素で、死細胞の細胞内に入り込んで細胞全体を青く染めます。よって、青く染まったものを死細胞としてカウントし、染まっていないものを生細胞と判断することができるため、極めて容易な操作で生細胞率を算出できる方法として利用されています。
ただし、サンプルに混在している細胞片や赤血球なども青く染まりますので、確実に排除するためにはある程度の経験が必要かもしれません。青く染まっている部位の大きさや形状で、適切に判断してください。
MTT測法
MTT試薬は細胞膜を透過し、ミトコンドリアに集積してミトコンドリア内の脱水素酵素により還元されてホルマザン色素を生成します。このホルマザンの生成量と生細胞数には比例関係があり、この生成量を測定することで細胞数に換算できます。但し、ホルマザンは難容性で析出するため、DMSOなどの有機溶媒で溶解してから吸光度を測定し、生細胞数を算出します。
トリパンブルーは毒性の強い発癌性物質です。取り扱う時にはラボ手袋、ゴーグル、白衣などを着用し、直接接触しないよう十分に注意してください。また、蒸気等は吸い込まないようにしてください。
トリパンブルーを注入した後、時間が経つにつれて生細胞も徐々に青く染まってきますので、迅速な計数が求められます。

5.4 細胞の継代(接着細胞)
接着細胞は、栄養供給やガス交換が適切であれば、容器の表面全体を覆うまで増殖します。継代は対数増殖期に行うことが重要で、接着している細胞を一旦、懸濁させてから分けます。重要な点は、トリプシンなどを利用した剥離処理は、適切な処理時間、処理温度で行うことにあります。
プロトコル
1.培養面積の70~80%ほど増殖した状態の細胞(サブコンフルエント)を用意する。※1

2.古い培地を吸引除去し、接着している細胞の表面を軽くPBS(-)で1、2回洗い 、吸引除去を行う。※2

3.トリプシン/EDTA溶液を、培養容器の容量に適した量を添加する。※3
容器の底を軽く叩くと(タッピング)細胞の半分程が剥がれる程度の状態(2~5分程度)で培地を4mL加えて攪拌し、15mL遠沈管に静かに移す。※4

5.130~150Gで3分間遠心を行い、上清を吸引除去したのち、新たに培地を 5mL加えて再浮遊させ細胞数を数える。※5、※6

6.目的の細胞数を新しい培養容器に播種する。容器を静かに揺らして、細胞が満遍なく均一に分散していることを確認し、CO2インキュベーターに入れる。※7

※1 細胞が一番状態の良い時期(対数増殖期)に継代します。100%のコンフルエントにまでなると、コンタクトインヒビジョンによって増殖能が低下してしまうことがあります。
(NIH 3T3細胞など)
※2 PBS洗浄では、容器をゆっくり揺らして細胞全体にPBSが触れるようにしてください。
※3 トリプシン処理は、細胞によって処理時間が異なり、適切な処理時間で処理することがその後の細胞の状態に非常に大きく影響します。
剥がれにくい細胞の場合はインキュベーションすることも有効です。トリプシンの添加量は培養容器の大きさに依存します。
※4 トリプシン処理が行われている間に次の作業の準備を完了しておいてください。トリプシン処理の時間は、剥がれるのを確認するまでの時間ではなく、培地を加える時までを指します。培地中の血清成分でトリプシンが不活化しますが、血清不含の培地の場合はトリプシンインヒビターを利用する必要があります。
※5 遠心は強くしすぎると細胞が痛むので、大体110~130G/3分程度に抑えると、良い結果が得られることが多いです。
※6 分散は、ピペッティングあるいは、遠沈管をタッピングして行います。ペレットが固すぎる時は遠心力が強すぎて細胞にダメージを与えている可能性があります。細胞の状態が良い時は、ペレットと培地の境界が比較的はっきりと見える傾向にあります。(全ての細胞には当てはまりません)
※7 培地容量は5~7.5mL/Tフラスコ(25cm²)程度ですが、継代直後は5mLで行う方が細胞接着を確実に行うことができるようです。
細胞には、それぞれに最適なスプリット比率があり、事前にどれくらいの比率で分けるのか調査が必要です。
5.5 細胞の継代(浮遊細胞)
浮遊系細胞は、希釈培養法によって比較的容易に継代することができます。
プロトコル
1. 顕微鏡で細胞の状態を確認し、細胞の凝集やコンタミの確認をする。※1 細胞密度の目安は1×10⁶cells/mLとし、3×10⁶cells/mL以上にならないようにする。※2

2. サンプリングし、細胞数を数える。

3. 計数した細胞数から得られた適切な希釈率にて希釈し、新しい培地に懸濁させる。※3

4. 3~5日おきに上記操作を繰り返す。但し適切な継代間隔は細胞によって異なる。※4
※1 細胞の状態をしっかりと確認することは重要なことです。数多く観察しておくことで、継代のタイミングの判断が容易になります。
※2 細胞によって最適な密度が異なりますので、あくまでも参考数値と考えてください。
※3 完全に培地交換をしてから継代を行う場合は遠心操作(130~150G/3分)を行い、培地の交換を行います。
※4 細胞密度が高くなると細胞自身が代謝する産物の蓄積により環境が悪化します。おおよそ1×10⁶cells/mL程度に達した時点での継代(希釈分注)を目安としてください。
5.5.1 培地の交換
増殖の状況が悪い細胞の場合、培地を半分だけ交換して増殖能の回復を試みることがあります。
1. 培養容器中の培地の半分量を、細胞とともに遠沈管に移す。

2. 110~130G/3分間で遠心操作を行い、上清を吸引除去したのちに、等量の新しい培地を加える。

3. 軽くピペッティング操作にて再浮遊させ、元の(半分量の培地が残っている)培養容器に戻す。
確実に上清(古い培地)を吸引したい場合は遠心操作を行いますが、通常よりも少し低回転域にて遠心することで、死細胞の除去も同時に行うことができます。
大量に細胞が必要な場合、フラスコやシャーレで増やした細胞をスピンナーフラスコや三角フラスコに移して培養を行うことがあります。基本、最初は培地量を少なめにして、低回転(低旋回数)で培養し、細胞の状態を確認しながら培地を加えると良いでしょう。細胞が増えてくると酸素要求度が高まりますので、容器への通気性を十分に確保してください。通気性のあるフィルター付きキャップを利用したり、強制的にエアーを供給したりするシステムの利用が便利です。
5.6 細胞の保存・凍結(接着細胞)
1. 培地面積の70~80%ほど増殖した状態の細胞(サブコンフルエント)を用意する。生存率が90%以上であることが望ましい。

2. 古い培地を吸引除去し、培養している細胞の表面を軽くPBS(-)で1、2回洗浄したのちに吸引除去する。

3. トリプシン/EDTA溶液を容器の容量に即した適量を添加し、容器の底を軽く叩く(タッピング)と細胞の半分ほどが剥がれる程度の状態(2~5分)で培地を4mL加えて攪拌し、15mL遠沈管に静かに移す。※1

4. 培地4mLを容器に加え、壁面に残った細胞を集め、15mL遠沈管に加える。一部をサンプリングして細胞数を数える。

5. 130~150G/3分間遠心を行う。※2

6. 培地を吸引除去した後に、細胞密度が1~5×10⁶cells/mLになるよう予め冷やしておいた細胞凍結保存液を加え、懸濁させる。※3

7. 各クライオチューブに1mLずつ分注する。チューブは必ず氷上で保持すること。

8. クライオチューブを密閉して、凍結保存容器(CoolCell/Biocision)に入れて、-80℃で凍結保存し、12時間以上してから液体窒素容器へ移す。※4
※1 剥がれ易い細胞では、コールドトリプシン法を利用した方が、細胞の状態を良好に保つことが可能な場合があります。(血管内皮細胞、膵臓細胞など)
参考:Journal of Zhejiang University-SCIENCE B(Biomed & Biotechnol) 2013 14(7):596-603
※2 細胞を遠心している間にクライオチューブや、予め冷やしておいた凍結保存液をベンチ内へ移動させておくと良いです。
※3 凍結保存液と細胞を氷上(低温環境)で十分に馴染ませることで、融解時の生存率向上が期待できます。
※4 信頼性の高い凍結方法として、プログラムフリーザーを用いた1℃/1分のレートで冷却する方法が勧められています。しかし、多くの研究室では高価なプログラムフリーザーでなく、CoolCell(Biocision)などの簡易型のフリージングコンテナを用いることで同等の効果を得ています。
フリージングコンテナ/CoolCell LX
CoolCell FTS30
【コラム:2】 意外な狙い目?細胞凍結融解の最終兵器!
細胞の凍結及び、融解作業はとても重要な作業です。品質の高い細胞を維持することは、実験結果を大きく左右する要因であり、この凍結・融解作業も細胞の品質に大きく関与しているからです。
以前から、より安全な細胞の凍結保存での重要なファクターは「凍結温度レート」だとしてプログラムフリーザーが登場し、-1℃/1minのレートでの冷却が理想とされていました。
それは、DMSOなどの凍結保護剤を細胞内に浸透させ、ゆっくりと凍結させて過冷却状態を維持し、細胞に影響を与えないような微小な氷晶を一気に形成させるためです。中途半端に急速に冷やしたりすると、冷却状態がブレイクして大きな氷晶が形成され、細胞に悪影響を与えます。(過冷却状態:0℃以下になっても直ぐには氷結しない状態で、瞬時に結晶が生成されるが、大きな氷晶が形成されにくい)
また、近年は融解時にも同様の配慮が必要であるとされ、ガラス転移点(Tg)や再結晶現象が関わっています。せっかく凍結時に注意して微細な氷晶形成にとどめていても、ガラス転移点以上の温度域で、再結晶現象が起きて細胞にダメージを与えてしまうことがあります。この現象を避けるために、素早く融解して再結晶の危険性を低減させることが求められています。
しかし、温め過ぎると凍結保護剤に含まれているDMSOなどが持つ毒性の方が優位になり細胞への影響が出てきます。よってチューブ(細胞)の温度を4℃付近に維持しながら予め用意していた培地へ加えることが必要です。
こうした情報を持たない作業員が安易に凍結チューブを恒温バスに浸し、適切なタイミングを理解せずに引き上げて振動を与えたり、逆にいつまでも恒温バスに浸けていたりすれば、細胞へのダメージは避けられないでしょう。
さて、この融解時の課題に注目したメーカーがありました!米国のフリージング製品を手がけているBiocision社*です。同社は2015年の初頭に「ThawSTAR凍結細胞融解ステーション」を発売しました。本製品は、チューブを装置に差し込むだけで自動的にチューブ温度を測定し、最適なレートでヒーティングを実施し、融解中も温度測定をしながらヒーター制御している優れものです。
水を使わないことも本装置の大きな特徴です。細胞処理センター(CPC)など、無菌性を重視する施設では、培養エリアで水を使用することを嫌います。
ThawSTAR 凍結細胞融解ステーション
ThawSTARは、そうした培養エリアの作業を安全且つ効率的に行うことを可能としました。
誰が操作しても同様の結果が得られる、高い再現性も喜ばれている要因の一つです。更に融解終了の10秒前からカウントダウンを行い、チューブを抜かないと警報がなる機能が装備されています。この機能は、融解終了後の氷上保存など、有用な作業を積極的に促しているものであり、細胞の高い生存率を維持するためにとても気の利いた機能です。
このように、細胞を良い状態に維持するための本質を理解した装置の登場が、細胞培養技術の標準化に繋がっていくものと考えられます。
備考:細胞は、ガラス化転移点(約–130℃)以下で安定した保存ができますが、それ以上の温度では不安定になり、失透現象のような結晶形成が起こる可能性があります。凍結、保存、融解の操作時にはこのガラス転移点を意識した作業が必要です。
*ThawSTARに関連する事業は、現在、米国BioLife Solutions社が継承しています。
6. 細胞の搬送
6.1 細胞の搬送
細胞の搬送には大きく分けて、生きたままでの搬送と、凍結しての搬送とがあります。
日本では国土が狭いこともあり、生きたままでの搬送方法の研究が進んでいますが、米国など広大な国土を持つ国や、バイオバンク事業に力を入れている欧州諸国などでは、凍結したサンプルの搬送の研究を積極的に進めています。生きたままの搬送では、培養容器に培地を満たして過度な低温、高温を避けて搬送すれば数日は持つと言われています。※1
また、搬送先の細胞受け入れ体制を整えておく必要もありますので、事前に到着予定時間や措置方法などの打ち合わせをしっかりしておくことが重要となります。
凍結した細胞の搬送では、ドライアイスを用いる搬送と専用の容器(ドライシッパー)を用いる搬送があります。ドライアイスを使用する場合は発泡スチロール箱に必要十分な量(1日で2~3kg目安)を入れ、緩衝材を用いて細胞保存チューブが破損しないようにしてください。また、ドライシッパーは液体窒素を吸収素材に含ませて低温環境を維持する容器で、転倒しても液体窒素がこぼれず、安心して搬送に使用できます。
ただし、事前によく冷却してから細胞を入れることが重要です。最初に入れた液体窒素の多くは蒸発してしまいますので、少し時間をおいて再充填してから細胞を入れてください。
更に、意外と忘れられがちなことは、保存容器から輸送容器へ入れ替えるまでの細胞の保存温度の管理です。運搬容器への移し替えは迅速に行い、常温にさらされている時間は最小限にしてください。
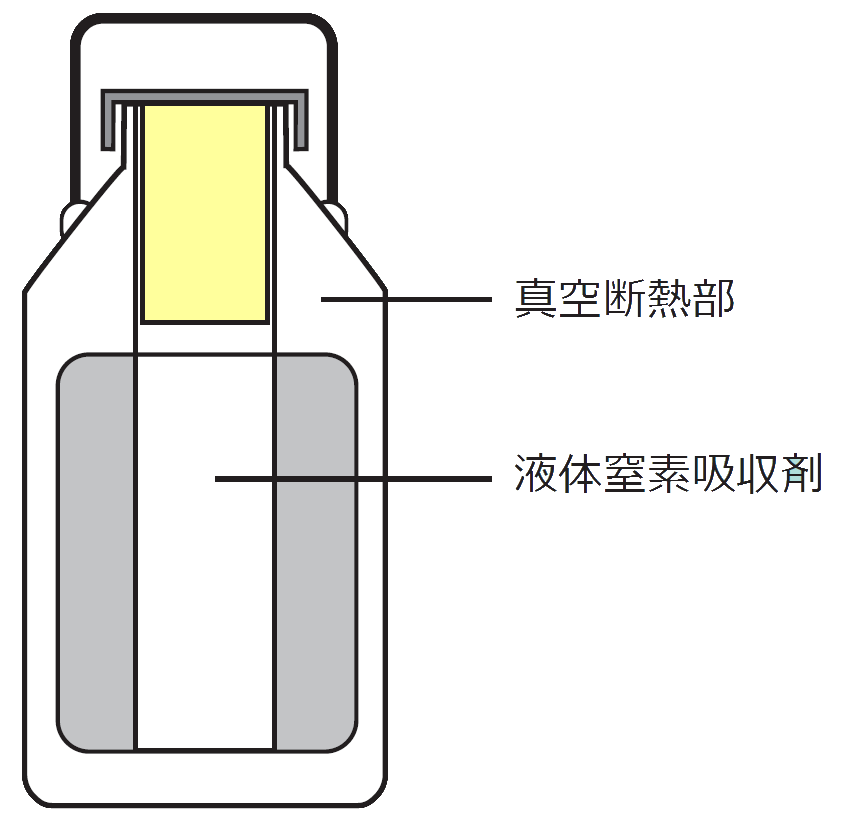
ドライシッパー:概念図
※1 4~36℃の範囲内で搬送時温度が制御可能な容器があり、細胞の性質や状態によって選択することができます。
短時間であれば特に保温をせずに搬送する場合もありますが、外気温には十分に気を付ける必要があります。
6.2 再生医療に用いる細胞の搬送
経済産業省が発行した「細胞・組織加工品の研究・開発におけるヒト細胞・組織の搬送に関するガイドライン2012」を元に、多くの機関、企業が、本ガイドラインに記載された項目に適合した、搬送容器をはじめとする搬送システムの構築を進めています。
ただ、搬送容器に入れるまで、或いは到着後の細胞の取り扱い作業の標準化も、実はとても重要なことであります。どんなに完全な搬送容器ができたとしても、容器に入れる前の細胞の状態が悪かったり、目的地へ到着してからの融解や確認培養の対応が悪かったりすると、細胞の品質は保たれません。医療での利用を考えるときには、この搬送前後の手順もしっかりと確立させなければならず、各方面で実証試験が行われつつあります。
搬送容器の大きな役割は主に「温度管理」「振動軽減」「記録」になります。温度変動を抑え、振動を軽減することと共に、ログを残す(記録する)ことも重要な役目であり結果的に細胞の品質を保証する一つの手段となります。各メーカーは、RFIDなどのICタグを用いたり、通信機能を用いたりして、サーバーにデータを送るなどの方策を取っていますが、これから更に研究が進み、最適な搬送容器が開発されるものと期待されています。細胞を凍結しないで20℃前後での搬送や、ジャイロ機構を用いての衝撃緩衝システムなども開発されています。
また、搬送容器だけでなく、運送業者自体も細胞など再生医療関連製品専用の体制を整えようとする動きもあります。再生医療関連製品運搬専用のトラックや、細胞搬送資格運転士など、一定の性能や技術を必要とする資格制度が誕生することは、もはや時間の問題かもしれません。「結果として、搬送された細胞に問題はない」のではなく、もっと能動的に「細胞に悪影響のない搬送システム」構築が望まれているのです。

 |
 |
| 再生医療製品専用トラック(架空) | 細胞搬送士(架空) |
7.細胞の評価
本章では、コンタミネーションの問題に加えて、今まではあまり触れられていなかった不可侵領域とも言える、細胞の評価、品質管理について述べていきます。
7.1 コンタミネーション
細胞培養実験において最も注意しなければいけないことにコンタミネーションがあり、大きく分けると2つの意味があります。一つは雑菌の混入で、環境中(主に作業者に起因する汚染)の微生物の混入があります。
もう一つはクロスコンタミネーションと呼ばれる実験対象(細胞)間での混入です。
培養過程で、元々使用していた細胞と異なる細胞とが入れ替わっていた事例が稀ながらも実際に起こっています。
微生物によるコンタミネーションを起こした場合は、貴重なサンプルを破棄しなければいけなくなり大きな損害となります。また、クロスコンタミネーションを起こした場合は本来の結果とは異なる結果が得られ、実験の正確性が失われます。いずれにしても多大なる損害となりますので、防止策が必要となります。基本的に無菌作業の徹底と、複数サンプルを同時に扱うことを禁止するなどの対策を講じることとなり、基本的な仕組みの構築と、作業員への適切な教育が必須となります。

7.2 マイコプラズマ汚染の対策
細胞培養において、マイコプラズマ汚染は研究者にとって大きな頭痛の種です。マイコプラズマは細胞壁を持たない微生物で、目に見えないことが汚染の拡大を余儀なくしています。また、通常培地の濁度やpHに大きな変化は認めらないことなども、汚染の確認が困難な要因の一つとなっています。
主な感染源としては、以前に感染して持ち込まれた培養細胞や、研究者自身と考えられています。
マイコプラズマに汚染すると、細胞に変化をもたらす可能性があり、免疫反応や遺伝子発現の変化を誘導する可能性があります。
問題は、この変化が新しい細胞株あるいは、新しい機能獲得と勘違いされてしまう危険性もあることです。実際に新たな細胞の機能だと思われたものが、実はマイコプラズマ汚染が原因だったとの例がありますので、十分な注意が必要です。
防止対策としては、新たな細胞を導入する時はマイコプラズマ汚染のないことがわかるまで区分保管しておくことや、培地や試薬類は必要な分量に無菌的に小分けしておき、常に使い切るようにして、残ったものは破棄するなどの措置を実施する必要が有ります。
また、重要な細胞は、一定の期間毎にサンプリングし、マイコプラズマ汚染の検査を実施することもお勧めします。
【コラム 3】 その細胞は目的の細胞?(STR、BAC Array、Proteome)
使用している培養細胞が、本当に目的とする機能を持った細胞なのか?と疑ったことはないでしょうか?つい最近までこの「細胞の品質」について語ることはタブー視されていたように思いますが、培養中の形態変化や、アッセイの結果がバラつくため、ストックを解凍して再実験した経験を持つ研究者は意外に多いのです。一体、この細胞の変化は何に起因して起こるのでしょうか?
様々な意見があるのですが、基本的に生物は自分に一番都合の良い環境に能動的に向かうものあり、培養細胞も同様だと考えられます。
外的刺激(ストレス)が細胞の変化を誘発しており、温度、pH、ガス環境、圧力、培地の組成、水、または周囲の細胞からの情報など、様々な影響を受けていると言われ、トリプシン処理や凍結保護剤のDMSOの影響も危惧されています。本当に細胞の性質は簡単に変わるのでしょうか?ますます細胞を利用した研究の重要性が高まるこの時代にこそ、この問題は真剣に考えなければいけません。
研究に用いる細胞の品質管理を考える上で重要な事項としては同一性(均一性)が挙げられます。さらに、医療に関与する細胞においては、安全性が重要視され、感染性、造腫瘍性、免疫反応などの評価が必要となります。実験に使用する細胞においては機能に変化していないことが前提ですので当然です。
しかし、細胞は化合物と異なり「生き物」であるため、一定のばらつきが必ずあります。
同一の細胞を同一の条件で培養することが基本ですが、それでも環境の変化や作業精度のばらつき、あるいは、偶然に異なる機能に変化する可能性もあります。更に、知らないうちに異なる細胞と入れ替わっていることもあります。
この細胞の同一性・均一性を維持するためには、何が同じでなければならないのか?逆に何が異なっていても構わないのか?など、現場の状況を鑑み、現実的な作業ルールや、指標(標準化)の構築が必要なのは明らかです。
そして、この培養技術向上において日本組織培養学会は「細胞培養士認定制度」を設け、培養技術の標準化に取り組み、研究者の意識改革を図っています。日本再生医療学会でも「臨床培養士認定制度」を設け、安全な再生医療の実践へと方向性を定めています。もちろん標準化の作業はそう簡単ではないと思いますが、それでもなお、大いなる成果を期待して止まないものであります。
細胞は常に「周囲の環境に適合した状態へ変化しようとしている」ことを前提にして実験を進めることは、とても重要なことなのです。
- STR(Short Tandem Repeat)解析:
ヒト細胞における誤認細胞排除の標準的な手法です。ゲノム上の様々な部位に存在する繰り返し回数の多型性を利用した遺伝子多型解析法で、9領域の組み合わせを統計学的に検定し、精度を高めています。階層的クラスタリングの最短距離法などを用いて、同一細胞であるかどうかの判断の一つとされています。 - BAC Array 解析:
目的の細胞と、比較対照となる細胞を異なる蛍光色素で標識を行ってハイブリダイズして目的の細胞のDNAコピー数の変化(増減:不均衝型変化)を解析する技術で、現在はPCRとの併用など、飛躍的に解像度が向上しています。 - Proteome解析:
細胞抽出液から、二次元電気泳動法にてたんぱく質の分離を行い、そのパターン解析に加え、その他手法(MALDI、HPLC、X線解析、NMR等)とも併用して、精度の高いプロファイリングを細胞品質評価に応用します。手法としては古典的ですが、解析技術の進歩が飛躍的に向上したことで、新たな知見が得られています。
8.細胞培養(技術)と知的財産
例えば、iPS細胞のように研究者の創造活動によって生み出された細胞においては、その樹立方法には特許が存在しています。(営利目的でiPS細胞を利用する場合、知的財権を管理するiPSアカデミアジャパンの許可が必要)もちろん特定細胞の樹立方法だけでなく、培養条件、培養液やサプリメント、培養容器、保存方法、原細胞特定、細胞選択方法、遺伝子導入方法など、周辺技術は特許に固められていると考えても良いでしょう。
現在培養している細胞または、これから培養しようとしている細胞には、どのような権利が付随しているのか…を理解した上で培養を実施することも必要となります。細胞培養技術と知的財産権(特許)の関係は、今後ますます密接になっていくと考えられているのです。
8.1 MTA(Material Transfer Agreement)
細胞バンクなどの機関や、研究者(大学)間による細胞の入手時においては、MTAと呼ばれる契約(同意書)を交わす必要があります。これは、研究に利用する材料(実験動物、細胞、遺伝子、化合物など)の提供を受ける時に交わす契約であり、この契約内容には支払いの条件や、第三者への提供可否、成果発表条件など、権利と義務に関する必要事項が記載されています。この内容に同意しなければ細胞を利用することはできません。ここでも、知的財産権の所在をしっかり認識し、内容を確認した上で研究に使用する必要があります。
8.2 特許出願戦略
実は、細胞培養に関わる技術は日々世界中で開発され、特許化されています。特にiPS細胞の製造に関する特許は2007年から2013年の間に世界で261も出願されています。
つまり世界中で数多くの新しいiPS細胞の製造方法が発明され、特許化されているのです。
研究者は営利目的ではないので特許には関係ない…と思われがちですが、実は大きな問題を秘めています。自分が開発した技術を公表及び、特許化しないでいた場合、あとから第三者が同様技術の特許を成立させた時には、いくら自分が先に開発した技術であっても、成立した特許に優先権があり、自らの実験に利用するときもロイヤリティの支払いを余儀なくされたり、最悪の場合は利用できなったりする可能性もでてきます。
有用な技術はまず特許化して権利を確定しておき、その技術を誰もが利用できるように広く門戸を開けることで、研究全体を促進させることも一つの戦略として考えらます。
また、産業化を目的とした一部の研究費申請においては、特許が論文発表以上の価値を持ち、研究費の獲得において有利に働くこともありますので、上手に利用すべきであると思います。
特許出願とは、実は営利目的だけではなく、自らの研究を守るための戦略的行動でもあるのです。
8.3 特許出願と学会発表
もしも、新しい細胞培養の技術を開発した場合、研究者であれば論文発表や、学会等での発表を一番に考えるでしょう。しかし、そこに特許出願が絡むと状況は少し変わってきますので、注意が必要です。
一般に、発明を公表した場合は「新規性」が失われ、特許の権利がなくなります。この公表とは、研究者が学会等での研究発表や、展示会、雑誌、インターネット、テレビ等での発表も含まれています。
ただ、公表と同時に公知の技術となったのですから、もう特許にすることはできない…と諦めるのは少し早いようです。日本においては、特許法第30条で新規性を失った発明に対しての例外が規定されているのです。
この「新規性喪失の例外規定」は、一定の要件を満たせば新規性を失わなかったことにみなされるとされ、以下の9項目が対象となります。
- 試験を行うことによる
- 刊行物等に発表
- 電気通信回線を通じての発表
- 学会で発表
- 研究開発コンソーシアムにおける勉強会や口頭発表、公開記者会見などでの発表
- テレビ等での発表
- 研究開発資金調達のための資本家に対する説明
- 博覧会、展示会への出展
- 発明者などの特許権者の意に反したこと
ただし、これらの項目に当てはまる場合でも、必ず6ヶ月以内に、上記項目に該当するとして例外規定を適用する旨の書面と同時に出願する必要があります。また、公表した人物と出願する人物が同一であることも条件となります。(複数の出願者の場合は、その出願者の中に含まれている人物が公表していること)
更に、30日以内に例外規定の適用要件を満たす証明書する書類提出が必要です。
そして、いくら6ヶ月の猶予があったとしても、その間に第3者が同様の特許を出願した場合など、いろいろと複雑な問題が発生してきます。よって、有用な新技術(発明)は、公表前に特許出願するか、あるいは公表後速やかに出願することをお勧めします。
また、上記の内容は日本や米国においてのことで、欧州には例外規定はありません。
ですので、もしも、特許化を望まれるのであれば、発表前の出願が望ましいでしょう。
9. おわりに
培養の相手は細胞という「生き物」です。その生きている相手と「会話」しながら最適なプロトコルを練り上げることが大事です。細胞も人と同様に個性がありますし、状態もその時々で様子が異なります。今日の細胞と明日の細胞がまったく同じ状態だとは誰も言い切れません。細胞と真正面から向き合い、眠りにつく時(凍結)、寝ている時(保存)、眠りから覚める時(融解)、移動する時(搬送)、増える時(培養)など、その時々の細胞と会話(観察)しながら、自らの研究に必要な機能を維持した細胞を育むことことが、「細胞培養」と言えるのではないかと思います。
最後に、本書が皆様の研究の手助けとなることを、切に願っております。
編集:山谷雅和/ワケンビーテック株式会社・開発センター
監修:小原有弘/国立開発法人医薬基盤・健康・栄養研究所
JCRB細胞バンク(培養資源研究室)
協力:横井宏理/横井特許事務所
上田忠佳/物産アニマルヘルス株式会社
(敬称略)