TOPICS
新型コロナウイルス関連記事
COVID-19検査と適正な微生物管理基準/方法

米国疾病予防管理センター(CDC)によると、COVID-19の検査にはウイルス検査と抗体検査の2種類があります。ウイルスまたは分子検査は、その時点で患者がSARS-CoV-2に感染しているかを決定するものであり、鼻咽頭ぬぐい液がサンプルとして使用されます。一方、過去の感染検査として知られる抗体または血清検査は、血液検査を用いて患者がウイルスに曝露しているかどうかが明らかとなります。COVID-19に対して行われる検査の大半は逆転写に基づいたウイルス検査です。SARS-CoV-2の遺伝物質は壊れやすく、一過性のもののため、採取されたサンプルは速やかに滅菌済みの輸送用チューブへ入れるか、氷または専用の培地に入れて分解を防ぐのが理想的です。
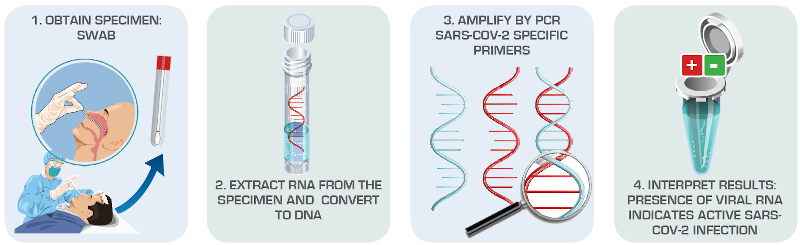
出典: American Society for Microbiology
これに対し、抗体検査は感染者の抗体反応を標的としており、ウイルスの遺伝的物質ではなく、ウイルスに対する抗体を検出します。抗体検査は1時間以内に結果が出ますが、専門家の多くはこのタイプの検査はウイルス検査ほど正確ではないと主張しています。抗体が感染から数週間後に産生されることが問題であり、抗体検査は初期診断には推奨されず、また無症状感染者を見逃してしまう可能性があります。
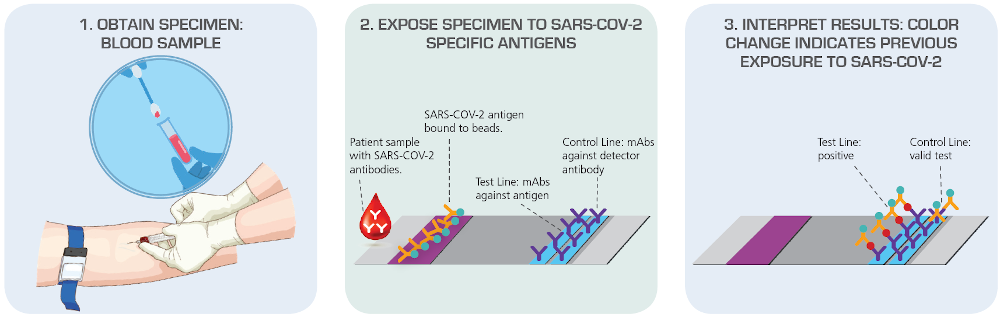
出典: American Society for Microbiology
試薬および消耗品
COVID-19検査実施のため、検査施設では、CDCが述べるウイルス検査キットの要件に応じ、次の物品が必要となります。全体としてコンプライアンスに従っていることを保証するため、不足の無いようにしてください。
- rRT-PCRプライマー/プローブのセット
- ポジティブコントロール
- RT-qPCRマスターミックス
- 分子生物学研究に対応するグレードの水(ヌクレアーゼフリー)
- パウダーフリー手袋(ディスポーザブル)
- P2/P10、P200、P1000エアロゾルバリアーチップ
- 滅菌済み、ヌクレアーゼフリーの1.5mLマイクロチューブ
- 0.2mL PCRチューブまたは96ウェル リアルタイムPCRプレートおよび光学キャップ
- 1.5mLマイクロチューブおよび96ウェルプレート、0.2mLチューブ冷却用のラック
- 1.5mLチューブラック
- 消毒剤
機器
消耗品のほか、ウイルス検査をモニタリング/実施するための環境を構築しなければなりません。日常的にPCRを行っている研究室はこの条件に適応している可能性が高いですが、そうでない場合、コロナウイルス検査を適切に行うため次の機器を揃える必要があります。
- ボルテックスミキサー
少容量のサンプルを効率的に混合する装置です - マイクロピペット(2または10、200、1000μL)
ディスポーザブルのチップを装着し、少量の液体をチューブ等へ移すための調整可能なピペット(校正済み) - マルチチャンネルマイクロピペット(5-50μL)
複数のチャンネルがあるピペット - 冷却ブロック:2×96ウェル冷却ブロック
試薬およびサンプル添加時に、サンプルチューブを保冷するためのブロック - リアルタイムPCRシステム
通常のPCR装置に光学検出技術の付いた装置
製品の詳細は次の画像をクリックし、製品紹介ページからご覧いただけます。
必要な消耗品・機器のリストに加え、COVID-19感染疑いのある人々から採取された検体からのウイルス分離は、BSL-2またはBSL-3の研究室において、関連技術および安全手順についてトレーニングを受けた者が行うべきだとCDCは強調しています。これ以外の場合、ウイルスの分離を試みるべきではありません。世界保健機構(WHO)もまた、臨床検査施設における各国の生物学的安全に関するガイドラインは、あらゆる状況下で順守すべきだと述べています。これに対し、WHOはCOVID-19に関する検体の取扱いおよび処理方法についてのガイドラインを発出し、非増殖診断(シークエンス、NAATなど)における必須の要件としてGood Microbiological Practice and Procedure(GMPP)を提唱しました。
Best Practice(最善の実施例)
- 研究室には食物や飲料、またバッグやコートなど個人的な物を置かない。研究室内では、飲食、喫煙、化粧などを禁止する。
- 研究室内では、ガムやペンなどを口に入れない。
- どのような生物学的物質でも、取り扱った後は研究室を出る前に温かい流水と石鹸で念入りに手を洗浄することが望ましい。
- 可燃性物質のあるところの近くに直火あるいは熱源を置かず、また放置しない。
- 入室前に、荒れた皮膚や傷はカバーすること。
- 入室前の段階で、試薬、個人防護具(PPE)、消毒剤を含む消耗品、機器は作業に十分かつ適したものでなければならない。
- 研究室の職員が、ものをこぼしたり、躓いたり、転倒するようなアクシデント・インシデントのリスクを軽減するため、備品は(保管手順に従って)適切かつ安全に保管する。
- 全ての試薬、薬品、放射性物質には適切にラベルを貼付すること。
- 特に、研究室から持ち出す可能性のある文書などは、プラスチック製のカバーを使用するなどして保護する。
- 作業は慎重に適宜行い、急がないこと。疲れているときは作業を行わない。
- 作業に不要な物品は片づけ、作業エリアは整理整頓し、清潔に保つこと。
- 注意力が散漫になったり、機器や施設の警報が聞こえない可能性があるため、イヤホンの使用を禁止する。
- アクセサリーは手袋の破れや、容易に汚染される/感染の触媒となる可能性があるため、カバーをするか取り除くこと。通常着用するような眼鏡や装身具については洗浄および消毒を検討する。
- 特に、特定の作業や実行中の手順に必要ないときは、携帯電子機器の使用を避ける。
- 携帯電子機器は、容易に汚染されない場所や感染の触媒とならない場所に保管する。生物学的薬剤との接近を避けられない場合には、研究室から退室する前に消毒するか、物理的なバリアを使用すること。
Technical Procedures(技術的方法)
- 検体を操作するときは、エアロゾルの発生を最小限に抑え、生物学的物質の吸入を避けるような手法で行う。
- 生物学的物質の摂取、および皮膚や目への接触を避ける。
- 検体を扱う際は常に使い捨ての手袋を着用する。
- 手袋を着用した手で顔を触らない。
- 操作中は口、目を保護する。飛沫が発生する場所では顔を保護する。
- 怪我および生物学的物質の侵入を防ぐため、尖鋭物および針は慎重に取り扱うこと。
- ガラス製品は可能な限りプラスチック製のものに変える。
- ハサミは先の尖ったものではなく、丸いものや鈍いものを使用する。
- シリンジの使用に係るリスクを最小限に抑え、アンプルの安全な取扱いのためにアンプルオープナーを使用する。
- 使い捨てシリンジへの再キャップやクリップ、針の除去は行わない。
- 針や針の付いたシリンジ、刃物、割れたガラスなどを廃棄する際は、密閉カバーの付いた耐穿刺性の容器を使用する。
Preventing Dispersal of Biological Agents(生物学的物質の飛散防止)
- 検体や培養液を廃棄する際は、専用の廃棄容器へ廃棄する前に、耐漏洩性のあるしっかりとしたフタのある容器に入れること。
- チューブを開栓する際は消毒薬を含ませたガーゼやパッドを使用することを検討する。
- 作業終了時、何らかの物質がこぼれていたり、汚染されている場合は適切な消毒薬で作業表面を消毒する。
- 効果的に、完全に不活化するため、消毒薬は取り扱っている病原体に対し有効なものを使用する。また、汚染された廃棄物に対しては十分な時間接触させること。
これらの実践例が厳格に行われ、適切な装置を使用した場合に、生物学的物質を取り扱った際の個人への曝露の可能性を最小限に抑えることができます。



