TOPICS
アプリケーションノート自動ライブセルイメージングシステム
Application Note:Adipogenesis(脂肪細胞分化・形成)のリアルタイム評価

Adipogenesis(脂肪細胞分化・形成)のリアルタイム評価
Celloger Proを使用
はじめに
脂肪細胞はエネルギーの貯蔵において重要な役割を果たしており、エネルギーが必要になる場合に備えて、余剰なカロリーを効率的に脂肪へ変換します。しかし、過剰な脂肪は、現代社会において様々な健康の問題に関わる肥満へとつながるおそれがあります1。また、脂肪細胞は代謝だけでなく、レプチンやアディポネクチンといったホルモンを分泌することにより、免疫反応や生殖機能2にも関与しています。
脂肪前駆細胞が脂肪細胞へと分化するAdipogenesisのプロセスは、種によって異なります。また、Adipogenesisが起こる割合は、生体内(in vivo)組織と、培養細胞(in vitro)でも異なります3。Adipogenesisに関与するファクターや、この複雑なプロセスを実行するメカニズムについては、積極的に研究が行われています。
Sylvia P. Poulos氏の報告によれば、細胞分化の割合は培地の組成により変化するとされています。また、Adipogenesisに関与する転写因子の発現レベルは、播種時でもコンフルエント後でも、時間とともに変化します。従って、様々な時点でAdipogenesisの程度を評価することが重要となります。Celloger Proのような、自動化ライブセルイメージング装置を使用すると、Adipogenesisの測定やモニタリングを容易に行うことができます。本アプリケーションノートでは、研究によく用いられている脂肪前駆細胞株、3T3-L1を使用した、分化プロセス中のAdipogenesisの評価方法をご紹介します。
材料と方法
細胞の維持とコンフルエンシー確認
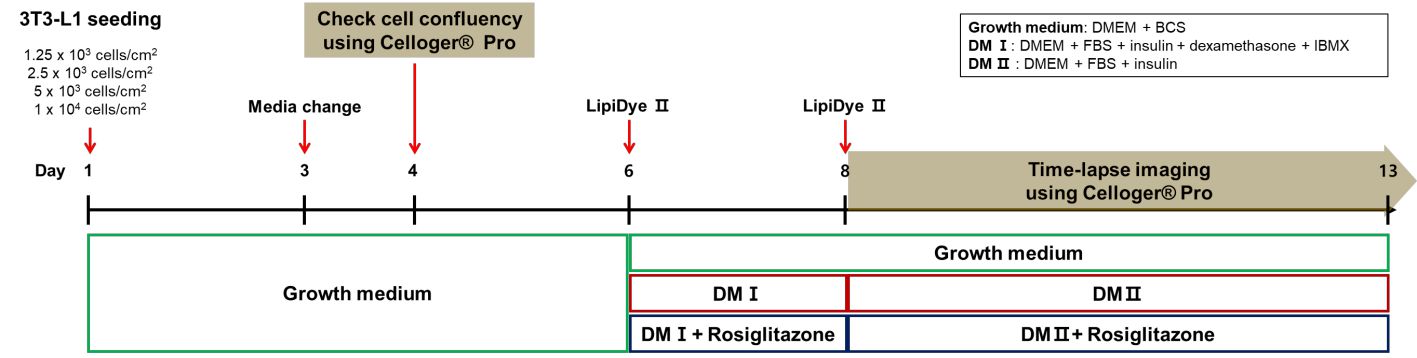
3T3-L1細胞は、10% BCS(子ウシ血清, Gibco, 26170043)、1% P/S(ペニシリン-ストレプトマイシン, Gibco, 15140122)を含むDMEM(ダルベッコ改変イーグル培地(高グルコース), Welgene, LM001-10)にて培養しました。コンフルエンシーが80-90%に達した段階で、継代を行いました。分化を促すため、12ウェルプレートに1×104 cells/cm2、5×103 cells/cm2、2.5×103 cells/cm2、1.25×103 cells/cm2の濃度で細胞を播種しました。播種後、2日目に培地を交換し、その翌日に4×レンズを装着したCelloger Proを用いて細胞密度の測定を行いました。
分化誘導用培地(DM)を用いたAdipogenesis誘導とAdipogenesis中の細胞形態観察
コンフルエント状態に達してから2日後に、10% FBS(ウシ胎児血清, Welgene, S001-01)、1% P/S、1µg/mL インスリン(インスリン溶液 ヒト, Sigma, 19278-5ML)、0.2µM デキサメタゾン(Sigma, D2915-100MG)、0.5mM IBMX(3-Isobutyl-1-methylxanthine、Sigma, 15879-100MG)を含むDMEM(以下、DM1)へ培地を交換しました。さらに2日培養した後、培地を10% FBS、1% P/S、1µg/mL インスリンを含むDMEM(以下、DM2)へ交換しました。
Adipogenesisにおけるロシグリタゾンの影響を評価するため、2µM ロシグリタゾン(Sigma, R2408-10MG)をDM1およびDM2へ添加しました。観察は、4×レンズまたは10×レンズを装着したCelloger Proを使用し、1時間ごとに撮影を行いました。
蛍光を用いた脂肪滴定量
分化プロセス時、脂肪滴の蛍光観察を行うため、1µM LipiDyeⅡ(FDV-0027, Funakoshi)を添加して培養を行いました。脂肪滴の面積を算出するため、Celloger analysisソフトウェアを用いて緑色蛍光のカバー率(%)を測定しました。Adipogenesisが起こる場所は不均一であり、評価の正確性を上げるため、1つのウェルで5つのランダムな位置において画像を撮影し、その平均値を算出しました。
結果
分化中の細胞形態変化の観察
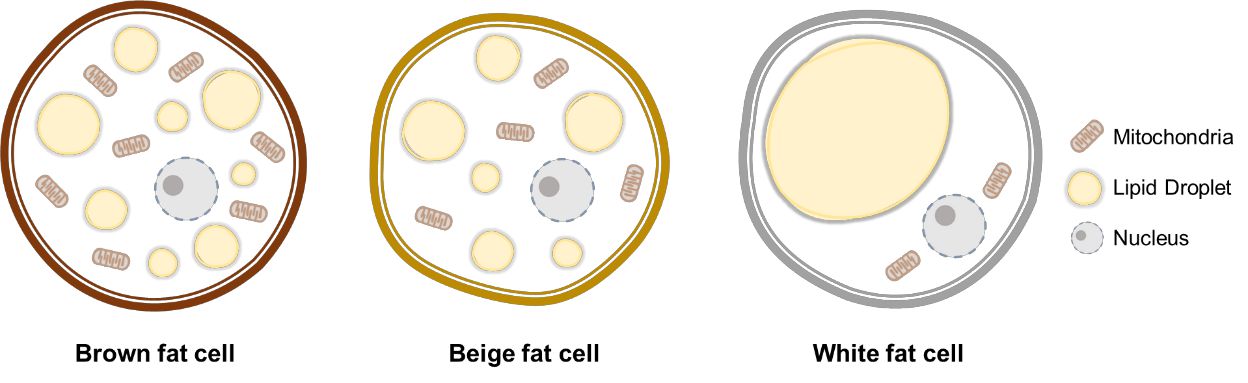
脂肪細胞分化中の最も大きな構造変化は脂肪滴の形成です。脂肪滴は1層のリン脂質により包まれたオルガネラであり、トリグリセリドやステロールエステルを含んでいます。脂肪細胞は褐色脂肪細胞、ベージュ脂肪細胞、そして白色脂肪細胞に分類され、それぞれが独自の特徴を有しています。1つの細胞に複数の脂肪滴を有する褐色脂肪細胞やベージュ脂肪細胞と異なり、白色脂肪細胞は細胞質の大部分を占める大きな脂肪滴を1つだけ有しているため、他の細胞と簡単に見分けることができます。(図1)
これらの3つの脂肪細胞はそれぞれ異なった機能を有しています。肥満によく見られる白色脂肪組織(WAT)は、主にエネルギー貯蔵として働く一方で、褐色脂肪組織(BAT)は熱産生によるエネルギー消費に役立っています。最近の研究で、BATから分泌されるファクターであるバトカインが様々な臓器に影響を与え4、代謝全体に影響を及ぼす4, 5ことが明らかとなっています。また、WATに位置づけられるベージュ脂肪細胞は、熱産生能力などBATに類似した特徴を示します。さらに、これらの細胞は成熟したWATから分化転換することができる6ため、多くの研究者から注目を集めています。
3T3-L1細胞の分化を誘導し、Celloger Proを使用して1時間ごとに細胞形態の変化を観察しました。図2は時間経過による3T3-L1細胞の分化過程を示しています。細胞継代により脂肪滴形成のタイミングは様々ですが、多くのケースではロシグリタゾンを含むDM2導入後、すぐに観察されました。大部分の細胞は、細かな脂肪滴を多く有する褐色脂肪様細胞へ分化しました。10×レンズを装着したCelloger Proでは、3µm以上の脂肪滴を水滴状の形として明確に識別できたため、染色を行う必要はありませんでした。
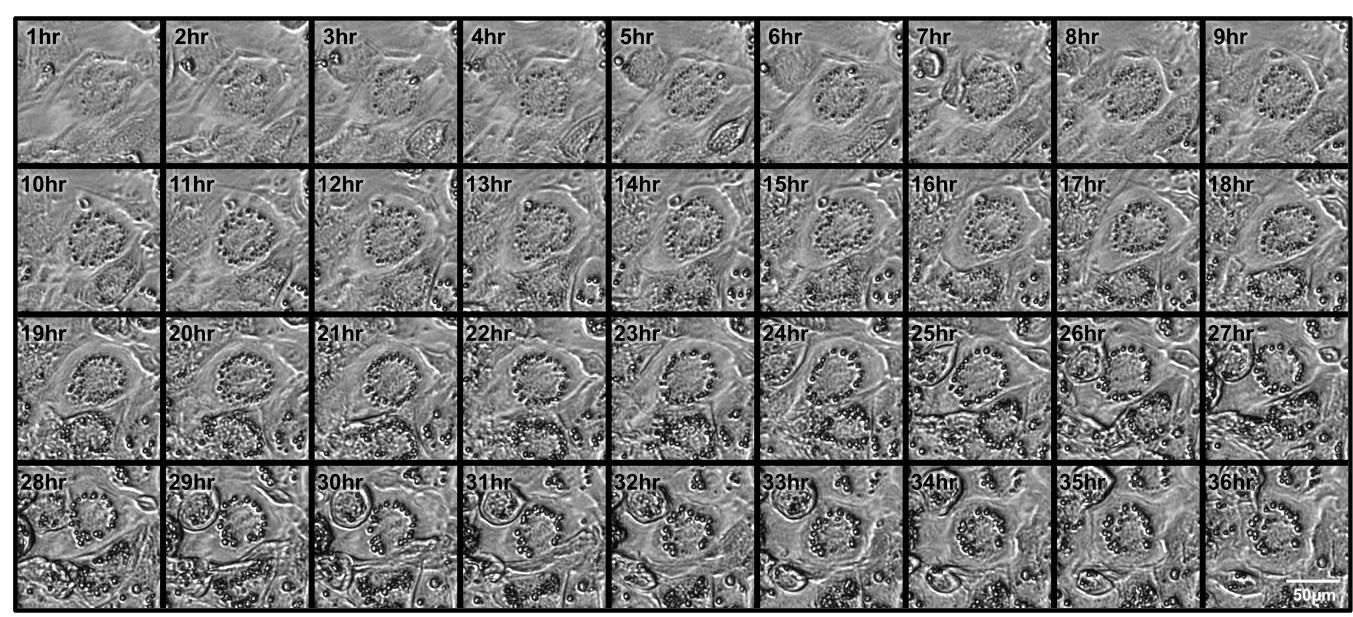
この一連のタイムラプス画像は、ロシグリタゾン添加DM2で処理した後、1時間後から36時間後まで、1時間ごとに撮影した画像です。(拡大率10×、トリミング済み)
脂肪滴のリアルタイム定量
多くの研究者は、オイルレッドOを使用して、脂肪滴の範囲を測定することにより、分化の程度を評価します。オイルレッドOは、脂肪滴のような脂質に富んだ構造物を染色し、顕微鏡下で観察できるようにするための色素です。しかし、生理的条件下での染色ができないため、時間経過による変化を観察することが難しくなっています。そのため、本実験では生細胞に最適な蛍光色素としてLipiDyeⅡを使用しました。LipiDyeⅡは、脂肪滴を染色するだけではなく、生細胞の観察も可能となるため、実験プロセスも簡素化できます。DM中において、LipiDyeⅡを含む細胞は、緑色の蛍光を特徴とする脂肪滴を徐々に形成しました。この蛍光シグナルは、明視野画像で観察された膜構造と完全に一致しました(図3)。細胞内の脂肪滴が不鮮明な場合(図3の矢印部)や、サイズが小さく明視野下で見分けがつかない場合(図3の点線で囲んだ部分)でも、蛍光を利用することにより簡単に検出することができます。
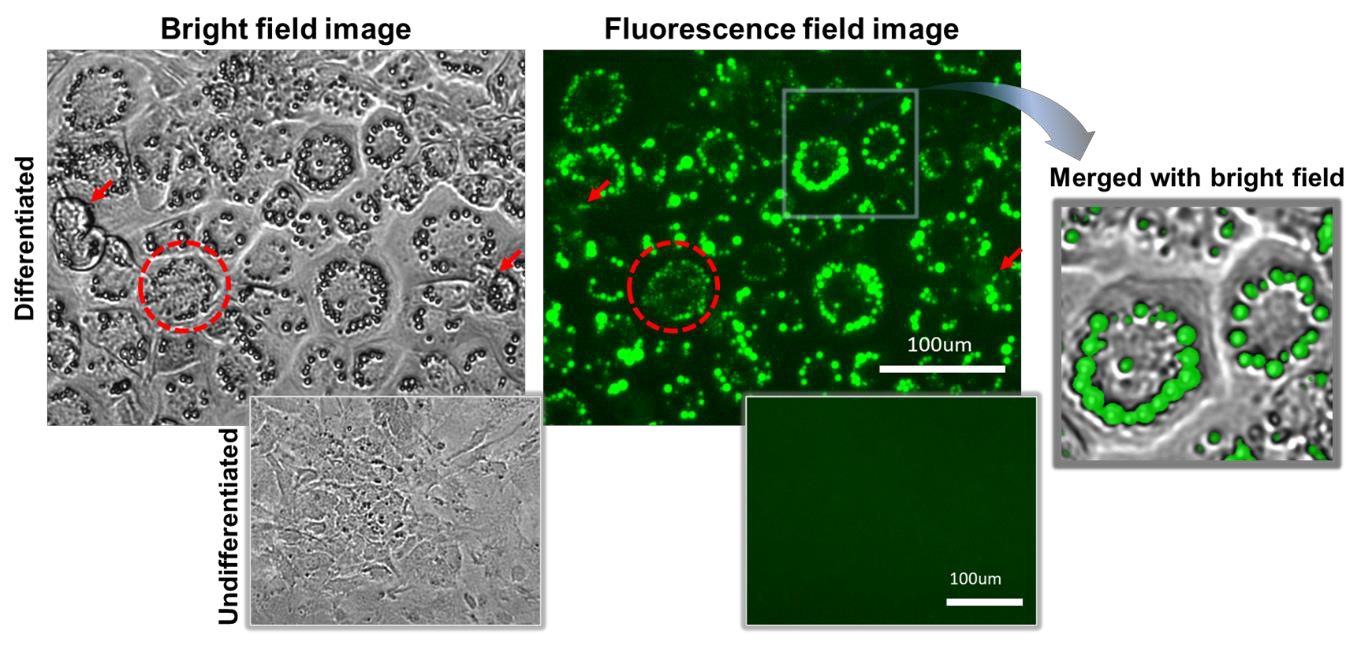
ロシグリタゾンを含むDM2およびLipiDyeⅡでの処理後、Celloger Pro(10×レンズ)にて24時間撮影を行いました。
脂肪滴により占められる割合を示す蛍光カバー率を測定し、分化率を確認しました(図4)。分化は、プレート全体で均一ではなくランダムに起こるため、全体的に解析を行うためには広いエリアでテストを行うことが必要です。しかし、2×などの低い倍率では小さな脂肪滴を正確に測定するには不十分です。そのため、4×の拡大率で、複数個所の観察を行うマルチポジションイメージングを利用することにより、少し広い範囲で脂肪滴の割合を測定し、より信頼性の高いデータを得ることができました。
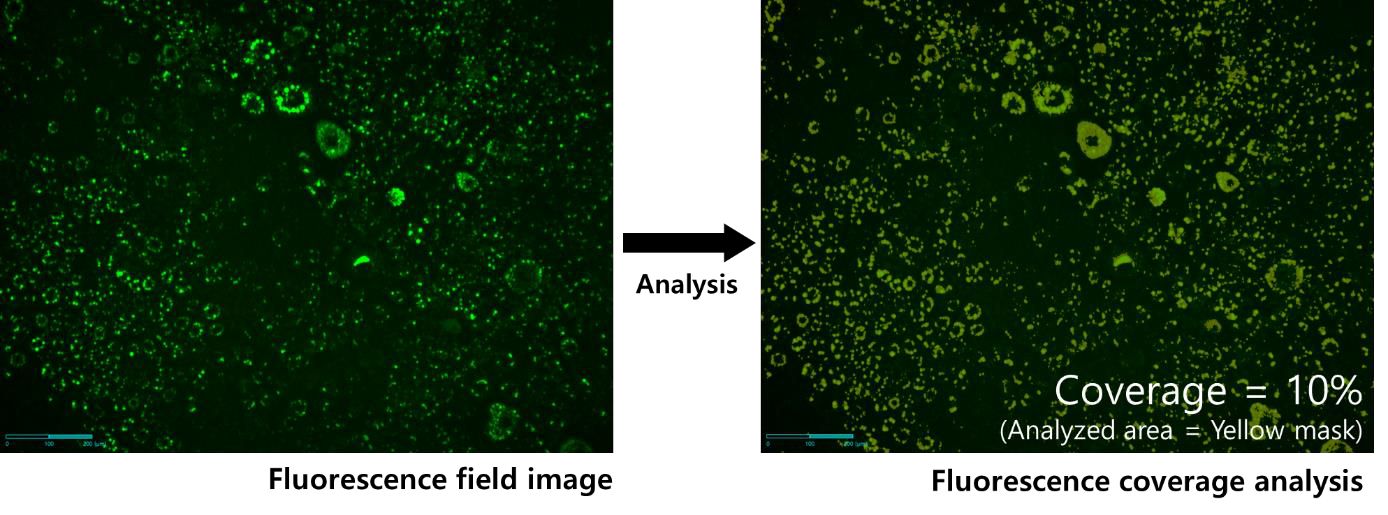
画像は、DMⅡおよびLipiDyeⅡで処理してから2日目に、Celloger Pro(4×レンズ)にて撮影しました。蛍光エリアは、適応的二値化※(Adaptive threshold)処理を行った後、Celloger analysisソフトウェアにて算出しました。
※適応的二値化:画像の各ローカルエリアのピクセル値に基づいてしきい値を算出する画像処理技術で、明度やコントラストが不均一な画像で効果的にセグメント化を行うことができます。
細胞濃度およびロシグリタゾン投与に基づく分化レベルの評価
脂肪細胞の分化プロセスは高度に制御されており、また、脂肪前駆細胞の環境や薬理学的介入などの様々なファクターにより影響を受けています7, 8, 9。中でも、分化誘導時のコンフルエンシーは、脂肪細胞形成の効率や質に影響を与える重要なパラメーターだと考えられています10。さらに、ロシグリタゾンのような薬剤(PPARγの強いアゴニスト)は、Adipogenesisの調節において重要な役目を果たすことが明らかとなっています11, 12, 13, 14, 15。PPARγは脂肪細胞の成熟や機能に関与する様々な遺伝子発現を促す重要な転写因子です。
脂肪細胞の分化における、細胞のコンフルエンシーとロシグリタゾン処理の相互作用を調べるため、以下の図5に示す実験スキームに従い、分化レベルの評価を行いました。
最初の細胞の密度が、脂肪細胞の分化にどのような影響を与えるのかを評価するため、3T3-L1細胞を4つの異なった濃度で播種しました。播種から3日後、指定した日に自動的に画像を撮影できるCellogerの予約機能を使用して画像を撮影し、コンフルエンシーのレベルを確認しました(図6a)。撮影したこれらの画像は、Celloger analysisソフトウェアを使用して、コンフルエンシーを測定しました(図6b)。この最初の評価は、以降の分化における細胞のコンフルエンシーの影響を理解するためのベースラインを確立する上で重要でした。
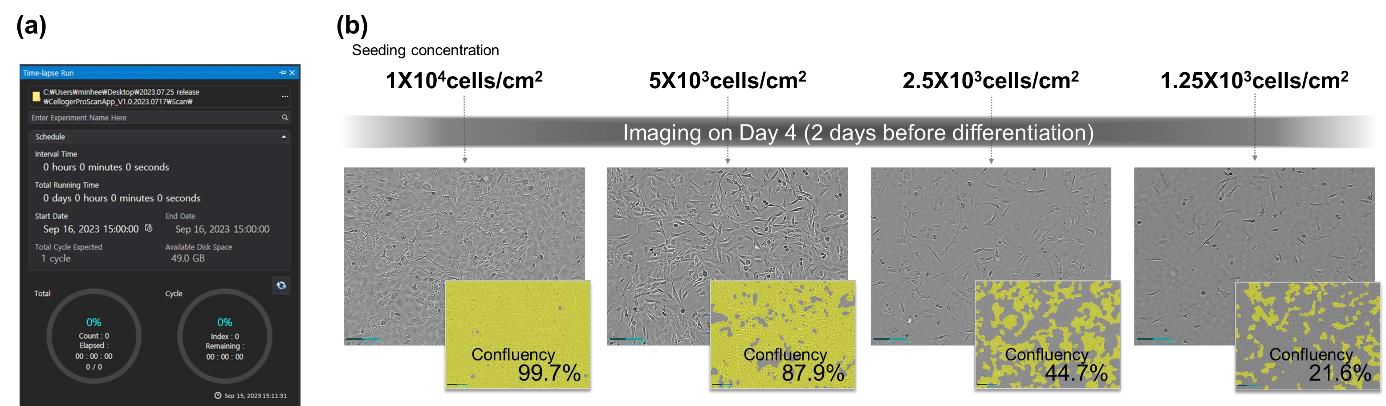
細胞を播種してから3日目に、Cellogerのタイムラプススケジュール機能を用いてコンフルエンシーの評価を行いました。
(a) Celloger scanソフトウェアのタイムラプススケジュールウィンドウ
(b) コンフルエンシーを解析した画像
6日目(コンフルエンシーを確認してから2日後)、脂肪細胞分化プロセスを開始しました。このプロセスにおけるロシグリタゾンの影響を調べるため、2つのグループで試験を行いました。1つ目は、ロシグリタゾンを含むDMで処理したグループ、2つ目は、ロシグリタゾンを含まないDMで処理したグループです(図5)。脂肪細胞の分化レベルを評価するため、LipiDyeⅡで処理した後、蛍光カバー率(脂肪滴のあるエリア)を測定しました。Celloger analysisソフトウェアを使用し、異なった5か所で測定を行いました。図7は、ロシグリタゾンを含む/含まないDMⅡを加えてから13日目(図7a)および5日間(8日目~13日目)(図7b)の観察結果を示しています。ロシグリタゾンの投与は、蛍光エリアの増加(脂質の蓄積増加を意味する)が示すように、脂肪細胞分化率を明確に増強しました。ロシグリタゾンを含まないDMⅡで培養した細胞の分化率は、120時間後でもわずか4.7%でした。一方で、ロシグリタゾンを含むDMⅡで培養した細胞では速やかに分化が増加し、分化率は97時間以内に16.6%に達しました。ただし、細胞濃度に基づく分化の程度では、殆ど差はありませんでした。
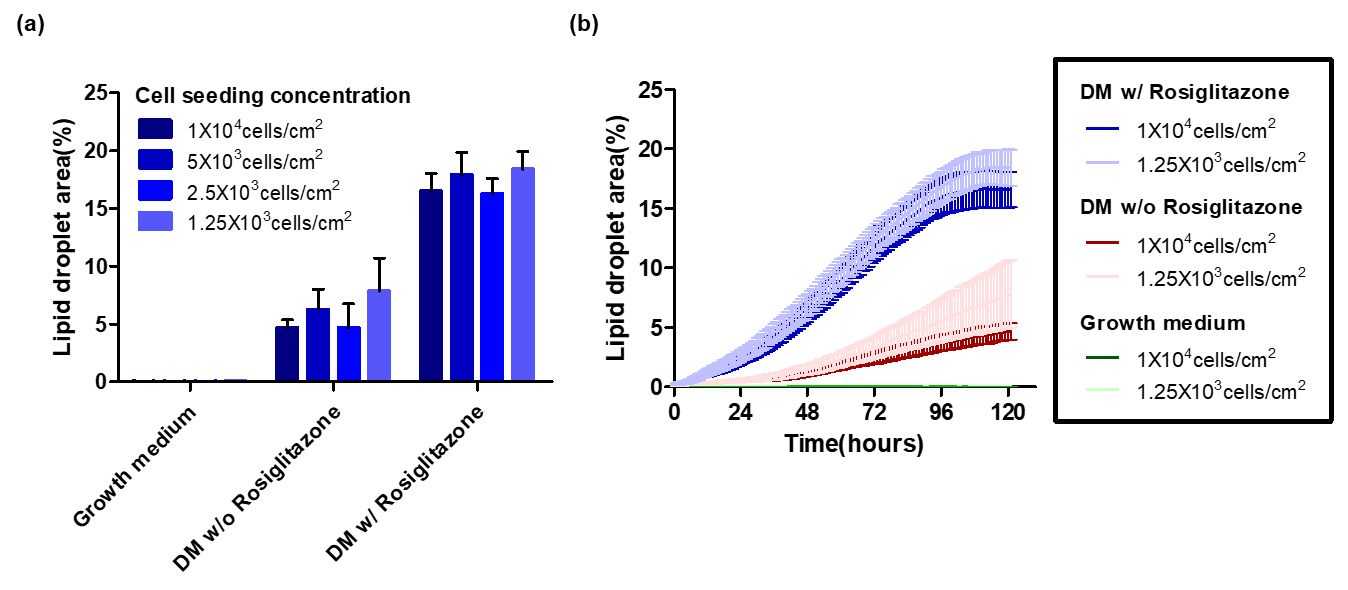
(a) 細胞濃度ごとの、Adipogenesisの程度(13日目)。エラーバーは標準誤差(n=5)を示す。
(b) DMⅡ添加後の時間経過による脂肪滴の生成グラフ(8日目~13日目)。5か所の異なる位置で蛍光画像を撮影。ピンクまたはスカイブルーの斜線は標準誤差を示す(DM w/Rosiglitazone: n=5, DM w/o Rosiglitazone: n=5, Growth medium: n=1)。
ロシグリタゾンを含むDMⅡで処理した細胞は、ロシグリタゾンを含まないものと比較して、分化が極めて早く増加しました(両側検定, p<0.0001)。Growth mediumのグループは、DM処理を行わなかった細胞です。グラフが複雑にならないよう、他の濃度は割愛しています。
結論
Adipogenesisは、様々なファクターの発現レベルによって制御される複雑なプロセスで、他の細胞成分との相互作用により、一時的に制御、影響を受けることがあります。これらの複雑なメカニズムを理解するには、長い時間入念に観察を行う必要があります。従来、研究者は分化時のある時点での特定マーカーの発現レベルを評価していました。しかし、Celloger Proシステムは、これらの経路の連続的な長期モニタリングが可能であり、このアプローチに革新をもたらします。タイムラプススケジュール機能を使用すれば、時間に追われることなく長期的な観察が可能となり、実験の効率を向上させることができます。Celloger Proの優れた特徴は、拡大率を変更できることです。これにより、高拡大率で脂肪滴の形成を観察でき、低拡大率では広い範囲の画像を取得することで、全体的な脂肪細胞の分化を評価することができます。また、脂肪滴を蛍光染色し、Celloger analysisソフトウェアを使用して蛍光強度を測定することで、分化レベルを定量化したり、観察された変化を数値化することができます。この機能は、脂肪細胞の分化を司るダイナミックな制御メカニズムについて貴重な知見を与えるとともに、健康においてAdipogenesisが果たす役割の理解に貢献します。
参考文献
- Lennarz, William J., and M. Daniel Lane. “Adipogenesis” Encyclopedia of biological chemistry. Academic Press, 2013. 52-5
- Britannica, The Editors of Encyclopaedia. "adipose cell". Encyclopedia Britannica, 18 May. 2020, https://www.britannica.com/science/adipose-cell. Accessed 28 November 2023.
- Poulos, Sylvia P., Michael V. Dodson, and Gary J. Hausman. "Cell line models for differentiation: preadipocytes and adipocytes." Experimental biology and medicine 235.10 (2010): 1185-1193.
- Yang, Felix T., and Kristin I. Stanford. "Batokines: mediators of inter-tissue communication (a mini-review)." Current Obesity Reports 11.1 (2022): 1-9.
- Ahmad, Bilal, et al. "Brown/Beige adipose tissues and the emerging role of their secretory factors in improving metabolic health: The batokines." Biochimie 184 (2021): 26-39.
- Cinti, Saverio. "Reversible physiological transdifferentiation in the adipose organ: symposium on ‘frontiers in adipose tissue biology’." Proceedings of the Nutrition Society 68.4 (2009): 340-349.
- Benchamana, Ameena, et al. "Regulation of adipocyte differentiation and metabolism by lansoprazole." Life sciences 239 (2019): 116897.
- Pu, Yong, and Almudena Veiga-Lopez. "PPARγ agonist through the terminal differentiation phase is essential for adipogenic differentiation of fetal ovine preadipocytes." Cellular & Molecular Biology Letters 22 (2017): 1-12.
- Teixeira, Catarina, et al. "Enhanced 3T3-L1 differentiation into adipocytes by pioglitazone pharmacological activation of peroxisome proliferator activated receptor-gamma (PPAR-γ)." Biology 11.6 (2022): 806.
- Cornelius, Peter, Ormond A. MacDougald, and M. Daniel Lane. "Regulation of adipocyte development." Annual review of nutrition 14.1 (1994): 99-129.
- Farmer, S. R. "Regulation of PPARγ activity during adipogenesis." International journal of obesity 29.1 (2005): S13-S16.
- Wabitsch, Martin, et al. "Characterization of a human preadipocyte cell strain with high capacity for adipose differentiation." International journal of obesity 25.1 (2001): 8-15.
- Tontonoz, Peter, et al. "Terminal differentiation of human liposarcoma cells induced by ligands for peroxisome proliferator-activated receptor γ and the retinoid X receptor." Proceedings of the National Academy of Sciences 94.1 (1997): 237-241.
- ebisch, Katja, et al. "Protocol for effective differentiation of 3T3-L1 cells to adipocytes." Analytical biochemistry 425.1 (2012): 88-90.
- Zhao, Xueyan, et al. "A comparison of methods for effective differentiation of the frozen-thawed 3T3-L1 cells." Analytical biochemistry 568 (2019): 57-64.
※本資料は、Curiosis 社の許諾を得て、ワケンビーテック社(弊社)が英語の原文資料を日本語に翻訳したものです。
Curiosis社や弊社の許諾なく複製、転載などを行うことはお控えください。

