TOPICS
特集記事
GMP環境中でのCR CTSシリーズインキュベーターのクリーニングおよび除染について

Introduction
細胞培養を行うクリーンルームあるいはそれに関連する環境において、微生物のコンタミネーションや粒子状の有機物片は、細胞治療に対するリスクを有しています。2010年には、バイオ医薬品の8.45%で微生物の混入が見られました[1]。また、2015年には、15-35%にマイコプラズマ類の混入が見られました[2]。2016年に行われた、およそ30,000件の患者の自己細胞を対象とした分析では、これらの血球細胞が特有の細菌を保持しており、またその割合は0.06%であることが示されました[3]。バイオ医薬品製造用細胞へのウイルスのコンタミネーションにも懸念が残ります[4]。また、微生物ではないものでも、危険性を有しています。例えば、2008-2012年の間に行われたFDAの回収のうち22%が[5]、また2009-2019年に行われた回収で2番目に多かった原因が非微生物粒子によるものでした[6]。これらのリスクにより、科学者や技師、その他のスタッフは、製造施設やクリーンルーム、またその中にある設備や備品のクリーニングや除染方法に重点を置いています。当然ですが、クリーニング剤や除染剤の過度な使用や不適切な使用は設備や器具にダメージを与えることがありますので、除染手順にはこれらの物質の適正使用の内容も含めるべきです。様々なクリーニング剤があり、また除染方法も多岐に渡るため、ここでは細胞・遺伝子治療クリーンルームおよびGMPに準拠した研究室やそれらの環境中にあるCO2インキュベーターに特化したクリーニング/除染方法(データに基づいた推奨の方法)をお示しします。
CR CTSシリーズに特化した手順で、またクリーンルームへの適合が認められている手順[7]です。

クリーニング剤、除染剤の選択 - メリットとデメリット
クリーニング剤は、濃度や組成が異なるものなど、多用な種類のものが存在しています。化学物質の中には、低濃度の場合はクリーニングに適しているものの、高濃度の場合は有害であるものや、時間経過により腐食を引き起こすものがあります。また、有害なガス(弱、中、強毒性)を発し、研究室のスタッフだけでなく培養細胞に影響を与えたり、蓄積毒性を示すものもあります[8,9]。リスクの程度は化学物質や濃度によって異なりますが、どんなものであっても安全性データシートやメーカーの推奨使用方法を確認することが重要です。
様々な材質に使用できる化学洗剤や除染剤であっても、研究機器には適していないものもあります。また、似たような材質のものであっても、使用する環境によって除染剤に対する耐性が異なる場合があります。例えば、ステンレス製のバイオセフティキャビネット(BSC)の表面に対しては除染剤の使用が適していますが、ウォーターバスは常に加温されており、また水が張られていますので適してはいません。
組織由来細胞を培養するCO2インキュベーター内では、その高い熱や湿度、そして特にCO2それ自体により、化学物質による腐食が大きくなります。CO2ガスは容易に液体に溶けます。この性質は、培地のpH緩衝に役立ちますが、インキュベーター内の高湿環境下においては、CO2によって炭酸が生成されることとなります。この炭酸と温度、高湿が合わさった状態に強い除染剤が加わると、相乗効果により腐食作用が増強されます。
加湿に使用する水の種類も、チャンバー内の腐食に関与する場合があります。いかなる場合でも、CO2インキュベーターの加湿水としては滅菌蒸留水を使用すべきであり、脱イオン水や、超純水(タイプ1)[10]などの高度精製水は使用してはいけません。これらの水はイオン濃度が極めて低く、高い反応性を示すためです。水は平衡状態になろうとするため、ステンレス、銅、ガラスなどの接触した物質からイオンを遊離させます。CO2インキュベーターのガラスドアがくもってきた場合、水がガラスの劣化を促進しており、近いうちにチャンバーにも影響を及ぼす可能性があります。滅菌蒸留水は、灌水(WFI)や培養グレード水として予め包装されている場合もありますが、いずれにせよ、導電率1-20μS/cm (抵抗率:50KΩcm~1MΩcm)である必要があります。
推奨されるクリーニング剤、除染剤
CO2インキュベーターで液がこぼれた場合(特に培地の場合)や汚れが付着した場合は速やかにクリーニングを行うべきです。これらの液や汚れは、微生物にとって栄養源となるためです。洗浄剤としては中性洗剤のみを使用し、また接触時間や残留を最小限に留めることをお勧めします。洗浄剤は、清浄な蒸留水や70%エタノール、70%イソプロパノールを使用します。
除染剤はメーカーの指示に従って使用してください。使用後は70%エタノールまたは70%イソプロパノールで残留した除染剤を拭き取ってください。
全ての除染剤について、使用方法や作用時間はメーカーの推奨事項を守ってください。また、毎回、残留した除染剤を70%エタノールまたは70%イソプロパノールで拭き取ることをおすすめします。表1は、推奨される除染剤のリストです。除染剤を扱う際は、常に手袋やゴーグルを着用してください。クリーンルームでの全ての作業のように、また、ISO14644-13[11]に従い、全ての洗浄や除染の作業については定められた適切な方法で行う必要があります。例えば、作業を行った後に、スワブ試験や拭き取り試験を行い、作業の有効性を記録することなどが挙げられます。
表1. 手作業でのCO₂インキュベーター拭き取り除染に対する推奨物質
表中の除染剤は、用法用量を守って使用した場合、ステンレス、ガラス、銅に対して使用可能です。他の薬剤を使用した後、その腐食性のある残留物を除去するために70%エタノールまたは70%イソプロパノールを使用することは非常に良い選択です。以下の表に掲載されていない除染剤については、インキュべーターの材質にダメージを与えるおそれがあることから使用をおすすめしません。100%純銅のチャンバーは、それ自身が抗菌性を有しているため、化学薬品による除染は不要です。なお、純銅チャンバーの表面を拭く場合は、70%エタノールまたは70%イソプロパノールを使用してください。
| 種別 | 濃度 | メーカー別 |
|---|---|---|
| エタノール | 70% | どれでも可(一般的に手に入るもの) |
| イソプロパノール | 70% | どれでも可(一般的に手に入るもの) |
| 第四級アンモニウム | 10%以下(2%以下のものが最適) | Conflilt™、Lysol™、No Rinse、Fermacidal D2™ |
| 過酸化水素 | 1-3% | どれでも可(一般的に手に入るもの) |
| 過酸化水素/過酢酸/酢酸 | 1%/0.8%/<10% | Spor-Klenz™ Ready-to-Use(RTU) Sterilant (Steris Life Sciences) |
自動化除染
自動化除染機能については、米国薬局方や欧州薬局方[12,13]の基準を満たすことが証明されている設計であることが重要です。これには、耐熱性芽胞菌であるBacillus subtilis(Bacillus atrophaeusとしても知られる)を少なくとも10⁶個減少させたという証明や、乾熱滅菌や過酸化水素ガス滅菌(VHP)に対して認められた指標菌などが含まれています。また、ファンやブロワーにより、チャンバー内の空気は継続して循環する必要があります。Thermo社のSteri-Run滅菌サイクルの有効性については独立した第三者機関の試験結果をご確認ください[14]。
VHPシステムは、高濃度では有毒であり、米国の労働安全衛生局によって、8時間/日の労働時間中の許容曝露量(PEL)が1ppmに制限されている[15]ことを充分にご理解ください。この理由により、VHP処理の有効性や、処理終了時に過酸化水素が中和されていることを証明することが重要です。湿度が厳密にコントロールされている環境においては、乾式の、非凝結性のVHPシステムのみが推奨されます。VHPが凝結して液体に変化すると、時間経過によって装置や材質に対し腐食を引き起こす可能性があるためです。VHPを行う業者は多くありますが、VHPには過酸化水素の他に、過酢酸、フェノール、酢酸によるプロセスが含まれますのでご注意ください。中には腐食を引き起こすVHPプロセスがあり、これらのプロセスについては推奨しません。Thermo Scientific™のCO2インキュベーターは、乾式・非凝結式の過酢酸処理Vaprox™(Steris Life Science)による複数回の試験を行い、これに対する適合性を確認しています[16]。なお、銅チャンバーの場合、VHPが純銅に結合して酸化を引き起こし、過酢酸濃度が低下するため注意が必要です。このため、100%純銅チャンバーのインキュベーターの場合は、Thermo Scientific社のSteri-Run自動滅菌サイクルを利用することをおすすめします[14]。
ワイプを使用した除染手順
- 再封が可能なパッケージから、消毒剤を含んだワイプクロスを一枚取り出します。下の例は、Spor-Klenz™ RTUディスポーザブルクロスワイプ(Steris Life Science社製)です。ワイプクロスは過剰に濡れたものではなく、均一に湿ったものを使用します。

- 空中でクロスを半分に折り、さらに半分に折り、四つ折りの状態にします。
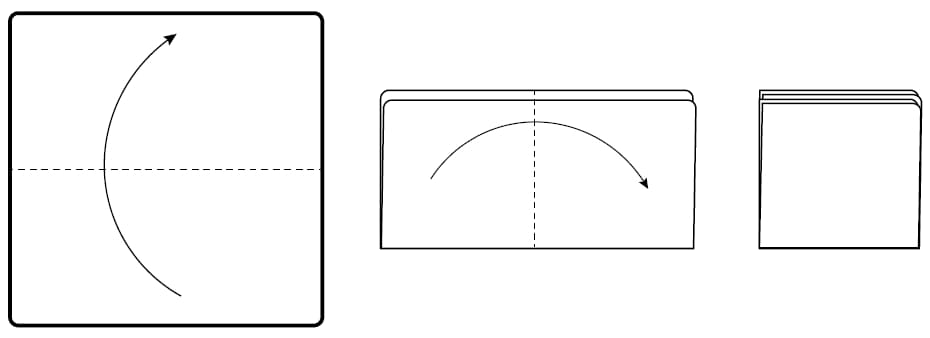
- 4つ折りにしたクロスを親指とその他の4本の指で持ちます。ヒダになった部分が手のひらを向くように、折り目が外側を向くように持ちます。
- 液体などがこぼれていたり、特に汚れている部分があれば、それ以上広がらないよう、最初にこの部分をクリーニングします。これらの後、他の部分のクリーニングを行います。
- 一番離れたところの一番上の位置からクリーニングを開始し、真っすぐ、自分に向かって拭きます。
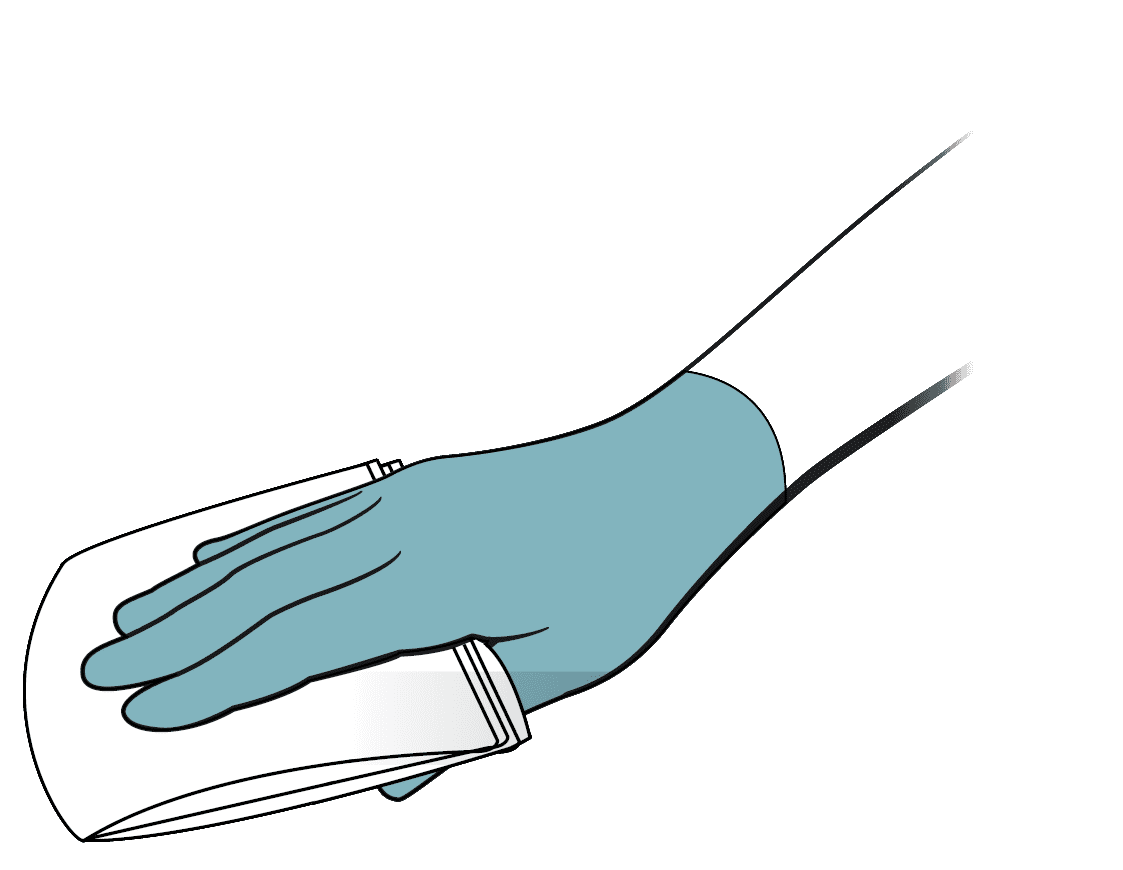
- 使用していない面が表になるようにクロスを折り返し、直線的な拭き取りを続けて行います。なお、このとき、先に拭いたところと10-20%以上重ならないようにしてください。各ストロークの拭き終わりの位置では、ワイプクロスを完全に表面から離してください。

- 手順を繰り返し、8面全部を使用したら、新しいクロスに取り換えてください。

- 表面全体の除染、クリーニングが終了するまで続けます。
CR CTSシリーズの除染およびクリーニング
- 培養容器を全て他のインキュベーターへ移動させます。
- ガス供給を停止し、本体の電源を切ります。
- 排水を受ける容器を準備し、クイック・ドレイン・バルブにチューブを接続し、ウォーターリザーバーの水を排水します。

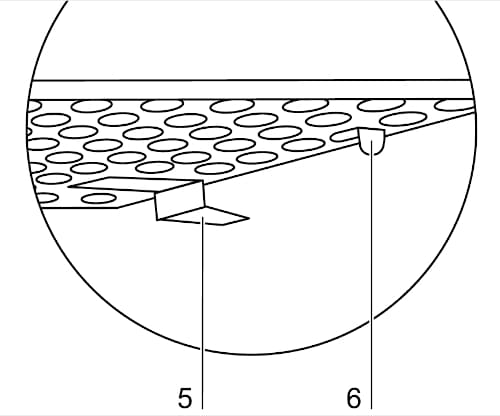
- 棚板、棚板サポート、棚板レールを慎重に取り外します。棚板を取り外す場合、棚板前部の転倒防止ストッパー(6)が棚板レールから外れるように少し持ち上げて手前にスライドさせ、脱落防止ストッパー(5)をレールから取り外してください。
- プレフィルター、エアボックス(HEPAフィルター含む)、ウォーターリザーバーカバーを取り外します。図の(1)ように、ウォーターリザーバーカバーを持ち上げます。
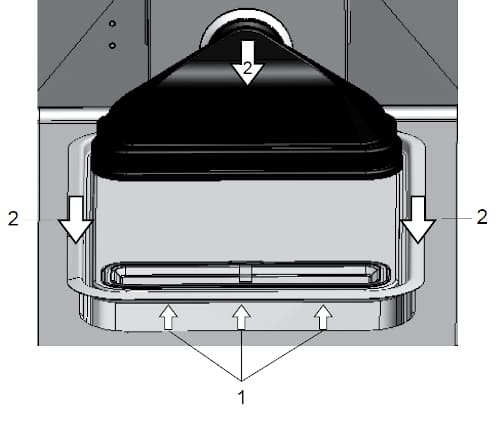
図の(2)のように、ウォーターリザーバーカバーを手前にスライドさせ、チャンバーから取り出します。次に、ウォーターリザーバーカバーから、エアボックスおよびHEPAフィルターを取り外します。
なお、この手順では、HEPAフィルターをエアボックスから取り外す必要はありません。ただし、この作業の後に、Steri-Run滅菌サイクルを実行する場合はHEPAフィルターを取り外して、廃棄または保管してください。HEPAフィルターを保管し、Steri-Run終了後に再度使用する場合は、プラスチックバッグまたは滅菌ラップ中で保管することをおすすめします。 - エアダクトをチャンバーの天井部から取り外し、続いてチャンバー奥のエアダクトを取り外します。
- チャンバー上面の奥から、手前に向かって除染剤を含ませたワイプクロスで拭きます。
- 次に、チャンバー奥壁を上から下に向かって拭きます。続いて左右の壁も同様に上から下に向かって拭きますが、拭き始めるときは奥から開始し、徐々に手前に移動させながら手前側で拭き終わるようにしてください。最後に、ウォーターリザーバーおよびその側面を、後ろから手前、左から右に拭きます。
- 除染剤として70%エタノールまたは70%イソプロパノール以外のものを使用していた場合は、70%エタノールまたは70%イソプロパノールを使用して7-8のステップを繰り返してください。
- 除染剤を含んだクロスを使用し、チャンバーの内部を拭きます。後部側の内側から開始し、次に外側を拭きます。70%エタノールまたは70%イソプロパノールを使用して同様に拭いてから、元の位置に戻します。
- 10と同様にエアボックスの外側(HEPAフィルターを取り外している場合は内側も)、ウォーターリザーバーカバー、プレフィルターを拭きます。
- 10と同様に、棚板サポート、棚板レール、棚板を拭きます。
- 10と同様に、ガスケット、ガラスドアの内側を拭きます。ドアを開いたまま上部、サイド、底面を拭きます。
- 10と同様に、ガラスドアの外側を拭いて閉めます。13のステップと同様に、外扉と外扉のガスケット周囲を拭いてからドアを閉めます。
- 装置の外装(上面および全ての側面)、脚、キャスターを除染剤で拭きます。必要に応じて側面、背面にアクセスする際は、キャスターを使用してインキュベーターを動かしてください。続いて、70%エタノール、70%イソプロパノールを使用して、同じく装置外装を拭きます。上下に積み重ねたインキュベーター間、およびスタッキングアダプターの除染には、クリーンルーム用のモップを使用してください。手で拭くのと同様に、モップも奥から手前に真っすぐに拭いてください。
- 終了時に、クリーニング、除染作業が正しく行われたことを検証するためのテストを実行します。
- インキュベーターの電源を入れます。
- 必要な場合は、ここでSteri-Run滅菌サイクルを実行します。
- Steri-Runの後、必要に応じてAuto-Startを実行します。
- 培養が可能な状態になったら、ウォーターリザーバーに滅菌蒸留水を入れ、ガス供給を開始します。チャンバー内の環境が安定したことを確認してから、培養細胞をインキュベーター内に戻してください。
参考動画:HEPAフィルターの交換方法(i160/i250)
結論
GMP準拠のクリーンルーム環境で使用される装置のクリーニング・除染は、遺伝子治療や細胞治療製品の製造において大きな意味を持っています。装置の品質を長期的に維持するには、適切な除染剤を選択することが重要です。不適切な除染剤を使用したり、誤った使用法は装置や再生医療製品に対してリスクのある腐食を引き起こすことがあります。本書で推奨する製品や手順は、CR CTSシリーズインキュベーターに対する互換性について、適切に選択され、テストされているものです。
参考文献
- Armstrong SE, Mariano JA, Lundin DJ (2010) The scope of mycoplasma contamination in the biopharmaceutical industry. Biologicals 38: 211.
- Wilder CN, Reid Y (2015) Mycoplasma quality control of cell substrates and biopharmaceuticals. American Pharmaceutical Review.
- Mizutani M, Samejima H, Terunuma H, Kino-oka M (2016) Experience of contamination during autologous cell manufacturing in cell processing facility under the Japanese Medical Practitioners Act and the Medical Care Act. Regenerative Therapy 5:25.
- Barone PW et al. (2020) Viral contamination in biologic manufacture and implications for emerging therapies. Nature Biotechnology 38:563.
- Tawde SA (2014) Particulate matter in injectables: Main cause for recalls. Journal of Pharmacovigilance 3(1).
- Eglovitch JS (2019) FDA: Despite improvement, particulate-related injectables recalls remain a concern. Pink Sheet, Informa Pharma Intelligence.
- Wronksi K, Bates MK, Low L (2021) Heracell Vios CR and Forma Steri-Cycle CR-CTS series CO₂ incubators achieve proven compatibility with an ISO Class 5 Grade A/B cleanroom. Thermo Fisher Scientific in press.
- Shen S, Yuan L, Zeng S (2009) An effort to test the embryotoxicity of benzene, toluene, xylene, and formaldehyde to murine embryonic stem cells using airborne exposure technique. Inhalation Toxicology 21(12):973.
- McDermott C, Allshire A, van Pelt FNAM, Heffron JJA (2007) Sub-chronic toxicity of low concentrations of industrial volatile organic pollutants in vitro. Toxicology and Applied Pharmacology 219:85.
- Thermo Scientific (2016) Smart Note: How can using the wrong type of water to provide in-chamber humidity cause corrosion in my CO₂ incubator? Thermo Fisher Scientific SNCO2WATER2016.
- International Organization for Standardization (2017) Cleanrooms and associated environments – Part 13: Cleaning of surfaces to achieve defined levels of cleanliness in terms of particle and chemical classifications. ISO 14644-13:2017(E).
- The United States Pharmacopeial Convention (2013) The United States Pharmacopeia and National Formulary.
- European Directorate for the Quality of Medicines & HealthCare, Council of Europe (2020) European Pharmacopoeia 10th ed. Strasbourg France.
- Thermo Scientific Steri-Run sterilization cycle proves total sterilization (2015) Thermo Fisher Scientific ANCO2STERIRUN 0215.
- The National Institute for Occupational Safety and Health, Centers for Disease Control and Prevention. Hydrogen peroxide.
https://www.cdc.gov/niosh/npg/npgd0335. html. Accessed 29 March 2021 - Thermo Scientific CO₂ incubators are compatible with multiple cycles of vaporized hydrogen peroxide (2021 in preparation).
本記事は、Thermo Fisher Scientific社のAPPLICATION NOTE "Cleaning and disinfection of a Heracell Vios CR or Forma Steri-Cycle CR CO2 Incubator in a GMP environment"(英語) を、弊社がThermo Fisher Scientific社の許諾を得て日本語訳したものです。英語原文は以下のリンクボタン(英語版)からご覧いただけます。

