TOPICS
特集記事
ウォーターフリーで凍結細胞を自動で融解! 凍結細胞融解ステーション ThawSTAR CFT2のご紹介
凍結細胞の融解をより安全・確実にするソリューション
ThawSTAR CFT2 凍結細胞融解ステーション
凍結細胞融解作業の標準化にお困りではありませんか?
一般的に凍結した細胞の融解はウォーターバスで状態を目視で確認しながら実施されます。ですが、ウォーターバスによる融解には以下のような課題がつきものです。
ウォーターバスによる細胞融解の課題
- 残氷の確認をウォーターバスから取り出して行うため、作業や作業者ごとに処理が安定しない
- 細胞融解の処理が作業者の主観により異なる
- ウォーターバスの水による、融解サンプルの汚染に注意しなければならない
以上のように、ウォーターバスによる凍結サンプルの融解作業は作業者や作業毎に処理が安定せず標準化が難しい作業です。また、水を使用する処理のため、コンタミネーションリスクが否定できません。
ThawSTARは、上記の問題を根本から全て解決します!
ThawSTARは水を使わず、コンタミネーションリスクを軽減し、1.8~2.0mL凍結チューブ*の融解を標準化することが可能です。
*サンプル容量は0.8~1.5mLを推奨いたします

水を使用せずコンタミリスクや管理の煩わしさがゼロ。水を持ち込めないCPCや高度クリーンルームに指摘です。
チューブはステーション上部のポートにセットして押し込むだけの簡単操作です。
自動で温度スキャンが実行され、最適な融解プログラムが実行されます。完了するとチューブがポップアップしアラームとイルミネーションでお知らせします。
- 3分以内に融解準備が完了します
電源に接続し、スイッチを入れるだけ。約3分で準備が完了します。
- 水を使用せず、安全キャビネット内でも利用可能
クリーンルームに持ち込みやすく、コンパクトなサイズで邪魔になりません。
- 作業者・チューブ温度にかかわらず均一な融解処理
凍結チューブをセットするだけの簡単操作。融解中の確認は不要です。
チューブの温度によって融解を自動補正し、温度に関わらず均質に融解されます。
 |
 |
| ①凍結チューブを本体中央の穴にセットし、押し込みます。 | ②チューブ温度をスキャンして分析し、融解処理が開始。(約60~90秒) |
 |
 |
| ③氷から水への相転移点を検知するとLEDで残時間を表示。残10秒になると音で通知。(約60秒) | ②チューブ温度をスキャンして分析し、融解処理が開始。(約60~90秒) |
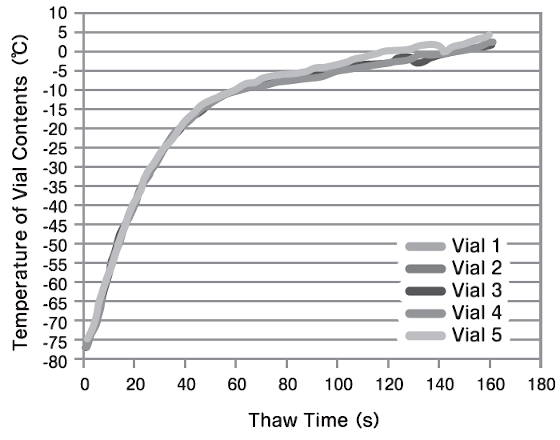
温度再現性の比較
2.0mLチューブに温度センサー(熱電対)を挿入し、1.0mLの水をCoolCellを用いて-80℃で凍結保存。37℃ウォーターバスとThawSTARで融解処理(3分間)を行い、5本のチューブで再現性を比較しました。ThawSTARではウォーターバスよりも高い再現性が確認できました。
 |
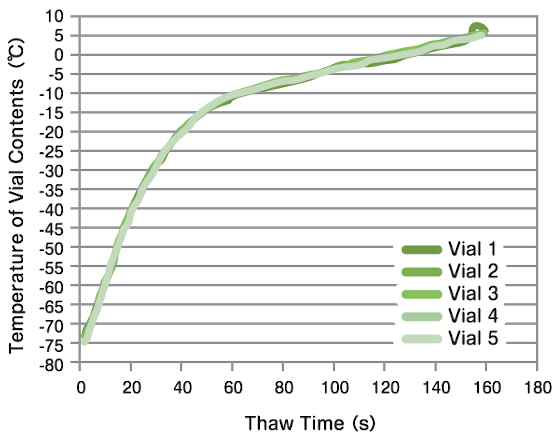 |
| ウォーターバス | ThawSTAR |
ThawSTARの融解温度プロファイル
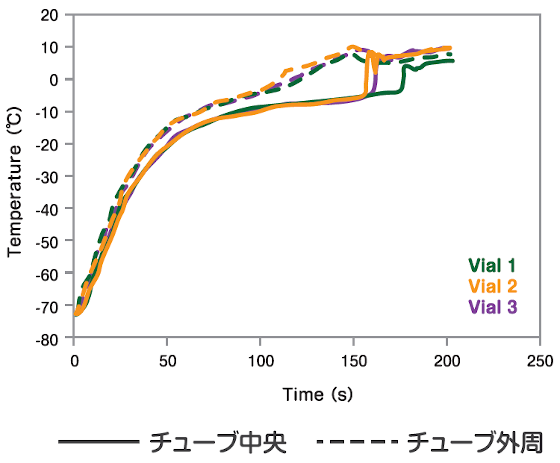 |
| 1.8mLチューブに1.0mLの凍結保存用培地(10%DMSO/20%FBS/70%DMEM)を分注し、チューブ外周(チューブ表面から0.5mm以内)とチューブ内中央部に温度センサー(熱電対)をセットしました。サンプルは-80℃で凍結させた後、ドライアイスで温度を維持し、ThawSTARにて融解処理を行いました。融解が完了しチューブがイジェクトされた際には、小豆サイズの小さな氷が見られました。
追記:チューブ内中央部のセンサー温度が急激に立ち上がっているのは、センサー付近の氷が溶け、崩壊したことを示唆しています。 |
対応チューブ
 |
| ThawSTAR CFT2およびThawSTARCFT1.5の対応チューブサイズです。サイズは目安であり、実際の適合状況は弊社までお問合せいただくか、デモ機をご用意しておりますので、お手元にてご確認をお願いいたします。また、チューブ適合表をご用意しておりますので、必要に応じてご覧ください。 |
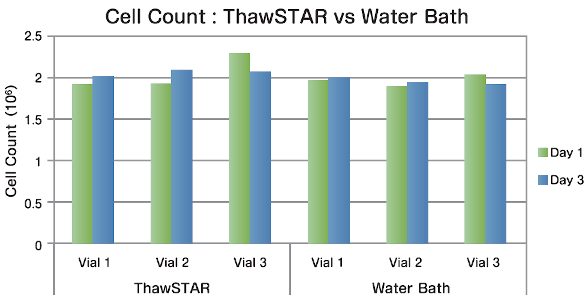
パフォーマンス
 |
 |
|
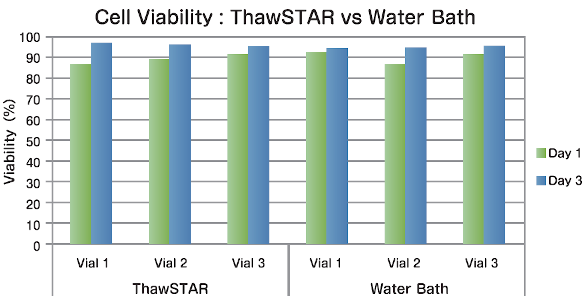
K562細胞(白血病細胞) 液体窒素での保存後、3本のチューブを一般的なウォーターバスとThawSTARを使用し、融解処理しました。細胞数と生存率を融解初日と培養3日後で比較したところ、いずれの結果においても同等の結果が得られました。
データ提供:MD Anderson Cancer Center |
|
 |
 |
|
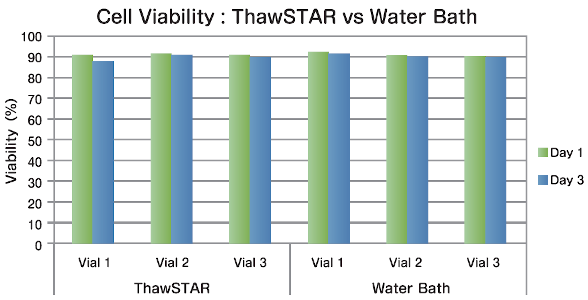
PBMC(末梢血単核細胞) 液体窒素での長期保存の後、3本のチューブを一般的なウォーターバスとThawSTARを使用し融解処理しました。生存率を融解初日と培養3日後で比較したところ、ThawSTARでの結果は従来法と同等でした。 データ提供:Blood Systems Research Institute |
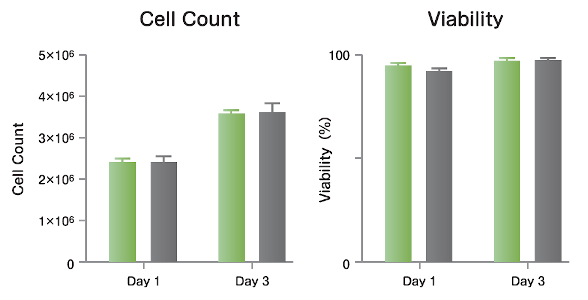
MSC(間葉系幹細胞) 液体窒素に保存した3本のチューブを、ドライビーズバスおよびThawSTAR CFT2を使用して融解処理しました。細胞数と生存率を融解初日と培養3日後で比較したところ、両者にほぼ差はありませんでした。(融解時間:ビーズバス ≻ 5分、ThawSTAR 2.5分) データ提供: Dr. Min Liu at Children’s National Hospital, DC |

ドライアイスをご利用される場合は、クライオチューブ・トランスポーターを使用した搬送をおすすめいたします。薄層ドライアイスを使用し、フタを閉めた状態で約1時間、-80℃を維持することが可能です。
 |
|
デモ機、その他のお問合せは、以下のお問合せボタンからご連絡ください。
製品情報は以下のリンクからご覧いただけます。

