TOPICS
アプリケーションノート
anvajo R-300アプリケーションノート vol.1
~細菌増殖とタンパク質含有量の測定~
fluidlab R-300
fluidlab R-300で細菌増殖とタンパク質含有量を測定する
※本資料はanvajo社が作成した資料(英文)を当社が日本語に翻訳したものです。本ページ下部のリンクボタンから、原文のPDFファイルをダウンロードすることができます。日本語訳に当たっては可能な限り読みやすいよう、一部内容を簡素化している場合がございます。英語原文と日本語訳の内容に相違がある場合は英語原文の内容が優先いたします。必ず英語原文と併せてご覧ください。
Introduction
タンパク質の機能や働きに関する生化学分析は、例えば、工業的プロセスのエネルギー消費を低減したり、極めて複雑な化学修飾を促進するために使用される酵素の産業利用に向けての最も基本的な研究のステップです。
従って、大量の酵素を得ることができる細菌での組み換えタンパクの発現は、研究室の重要なタスクだと言えます。
本資料では、anvajo社のコンパクトな装置であるfluidlab R-300を用いて、発現系における品質管理ができることをご紹介いたします。OD600による細菌の増殖曲線の正確な評価と、Bradford法によるタンパク質の比色定量が含まれます。
fluidlab R-300は、スクリーニング試験で設定した標準パラメーターを生産工程でそのまま使用することができます。つまり、次工程へ移行する際の追加ステップが必要ありません。
Material and Methods
クトースオペロンで制御される目的のタンパク質遺伝子と同様に、ネガティブセレクションとしてクロラムフェニコール耐性遺伝子をもつpLEMOプラスミドを用いて、Lemo21 E. Coli を形質転換しました。
モデル酵素としてシトクロムP450(芳香族化合物のヒドロキシル化を起こす酵素)を選択し、発現を試みました。
ヘム基を取り込んだホロ酵素を充分な量得るために、塩化鉄(Ⅲ)とδ-アミノレブリン酸をLB培地に加えました。
増殖曲線
オーバーナイトで前培養したE. Coliを接種した後、37℃、90時間一定速度で振とう培養し、濁度測定を行いました。
fluidlab R-300 サンプルキャリアアダプター03(外寸12.5×12.5mm、光路長10mmキュベット用のアダプター)を使用し、600nmで測定しました。
予備実験から、対数期は0.3(IPTGによる転写活性化が可能な段階)で始まることが示されました。
検量線、細胞溶解とタンパク質量の決定
総タンパク量を決定するための検量線は、ready-to-useタイプのブラッドフォード試薬(Sigma, ドイツ)にウシ血清アルブミン(Sigma Merck、ドイツ)を使用して作成しました。
細胞膜を可溶化するためにTriton-Xバッファーを使用して、超音波破砕を行いました。
その後、上清を使用して、分光光度法によりタンパク収量およびヘム取り込み量の測定を行いました。
Results
増殖曲線
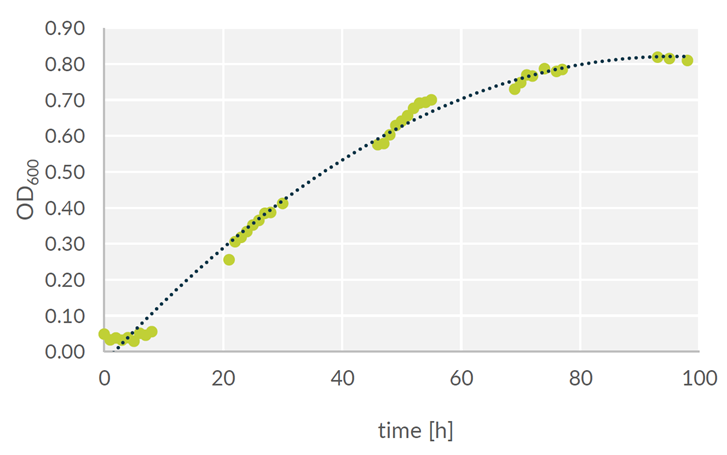
図1は増殖曲線です。定常期のOD約0.8まで、線形の増殖が見られました。
検量線
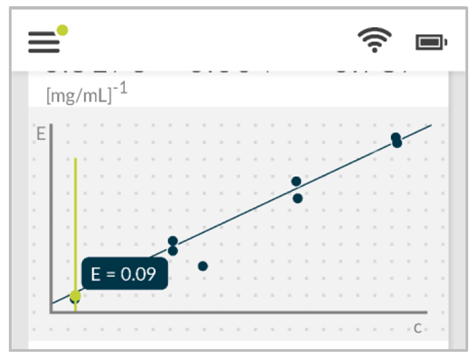
Calibration Curveアプリケーションを使用し、BSAを用いて検量線を作成しました。R²は0.98でした。(図2参照)
タンパク質の濃度決定
Calibration Curve内の、Concentrationアプリケーションを使用し、細胞ライセートのタンパク質濃度を3回測定しました(図3参照)。
CV値は吸光度で1%、濃度で2%でした。
| Sample | 1 | 2 | 3 | Mean |
|---|---|---|---|---|
| Extinction | 0.304 | 0.302 | 0.297 | 0.301 |
| Concentration(mg/mL) | 418 | 438 | 416 | 424 |
分光光度法によるヘム取り込みの観察
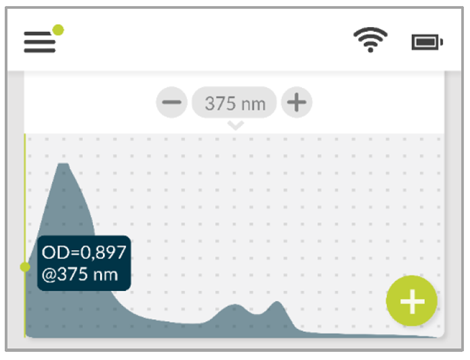
上清は421nmに典型的なピークを示しました。また同時に、575nmと600nmに、沈殿またはヘムの取り込みミス、もしくは他の金属イオンを取り込んだものと考えられる2つの小さなピークを示しました。(図4)
ヘム占有率の推算
ヘム部分のモル吸光係数は分かっているので、モル比が決定できます。
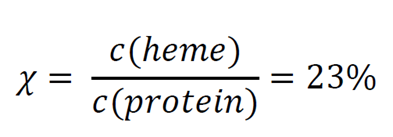
Discussion
E. coli などの異種発現系は、多くの研究分野において重要なツールです。今回、fluidlab R-300を使ってシトクロムP450酵素発現に関する評価を行いました。
本試験において、fluidlab R-300と標準品とを比較して、合成した酵素の評価ができること、またヘム取り込み率が23%になることが示されました。我々は、この数字をより詳細に評価するには、3つのアクションが必要だと結論付けました。
まず初めに、発現したシトクロムP450は、Bradford法で測定したペプチドのうちのほんの一部であり、また、この分画はSDS-PAGEもしくは質量分析法も使って測定するべきだということです。
2つめは、この細胞ライセートは遠心分離を行っていないために不純物が多く含まれており、この不純物のピークが実際のヘム含有画分の付近に近似UVピークとして現れたことです。
そして3つめは、酵素を目的とする分画に移動させてヘムの取り込みを改善するため、細菌による塩化鉄(Ⅲ)とδアミノレブリン酸の取り込みをモニタリングするか、または少なくとも変化させるべきだということです。
例えば、キレート剤としてFerrozineを使用し、分光光度計により比色定量を行うことで再度モニタリングが可能です。
最後に、この評価の全行程はコンパクトなfluidlab R-300を使用して行いました。
本装置を使用することで、例えば生産環境などにおいて、他の分析系を使用することなく品質管理を行うことができます。
以下のリンクボタンから、PDFファイルをダウンロードできます。

